肿瘤完全消失!mRNA疫苗联合PD-L1成实体瘤的"终结者",横扫胃癌、肠癌等11大癌种!
mRNA疫苗联合PD-L1治疗肿瘤完全消失,横扫胃癌、肠癌等11大癌种
从20世纪90年代起,mRNA就被应用于治疗性疫苗,直到2020年Covid-19(新冠病毒)大流行的时期,mRNA疫苗的一鸣惊人使其相关技术成为新一代疫苗的候选者。
2023年10月2日,诺贝尔生理学或医学奖揭晓,两项重大发现荣誉获奖。这两位获奖者,Katalin Karikó博士和Drew Weissman博士,因其对mRNA疫苗的突破性贡献,共同赢得了这一全球科学领域的至高荣誉。mRNA技术属于新一代的免疫疗法,其中文意思是“信使核糖核酸”,mRNA是一种天然分子,能向人体细胞发出指令,然后制造靶蛋白或抗原,从而激发出人体的免疫反应。
用mRNA技术开发肿瘤疫苗的优势,在于很容易能同时表达20个以上的肿瘤抗原,因此格外适用于癌症的个体化治疗,即使是很小的肿瘤样本组织,也可以采集到所有的抗原信息,从而定制个性化肿瘤疫苗。
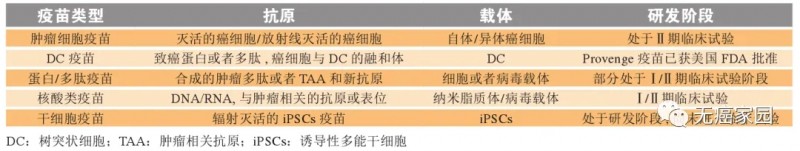
▲ 肿瘤疫苗类型及作用范围
虽然目前还没有临床上市的mRNA肿瘤疫苗,但是许多制药企业已经开展了肿瘤疫苗研发管线,相当一部分产品已进入I期和II期临床试验阶段。在对抗实体瘤方面,部分研究学者将目光聚焦在mRNA疫苗领域,这也是小编今天要讲的主角!
病灶完全缓解且生存超3年!Cevumeran疫苗治疗实体瘤疗效惊艳
近日,国际著名医学期刊《Nature Medicine》刊登了基于mRNA的个体化新抗原特异性免疫疗法autogene cevumeran (BNT122),与PD-L1阻断剂atezolizumab(阿替利珠单抗,Tecentriq)和化疗连用,在晚期实体瘤患者中的1期临床研究结果。
自基因 cevumeran(BNT122/RO7198457)是一种基于mRNA的个体化新抗原特异性免疫疗法,该疗法根据从每位患者肿瘤组织中获得的肿瘤特异性体细胞突变数据设计,以刺激针对多达 20 种新抗原的 T 细胞反应,旨在降低肿瘤复发风险并延长患者生存时间。
纳入本次研究的213例患有癌症和局部晚期、转移性或复发性无法治愈的恶性肿瘤的患者,主要包括胃癌、微卫星稳定性结直肠癌、三阴性乳腺癌、黑色素瘤、肾癌、肾细胞癌、尿路上皮癌、非小细胞肺癌、直肠癌。
研究结果显示,黑色素瘤患者(n=9)客观缓解率为33.3%,肾细胞癌患者(n=12)客观缓解率为33.3%;尿路上皮癌患者(n=11)的客观缓解率为 18.2%;非小细胞肺癌患者(n=10)的客观缓解率为10.0%。
在剂量递增队列中,个别患者表现出持久的临床益处:胃癌患者在 50 μg 单药治疗队列中达到完全缓解(CR)。联合治疗队列中,直肠癌、乳腺癌患者分别达到完全缓解(CR)和部分缓解(PR)。
典型病例
01、【胃食管腺癌】
患者 18 患有 CPI 初治微卫星不稳定性高、PD-L1 低、HER2+ 胃食管腺癌,肝脏有 1 cm 靶病变,之前曾接受过三种全身疗法治疗,在接受 8 剂 50 µg 自体基因cevumeran单药疗法后达到完全缓解,反应持续时间为 21 个月。从完全缓解(CR)确认之时起直到患者在第 39 周 CR 时的最后一次随访,CD8+T细胞反应一直保持在高水平。
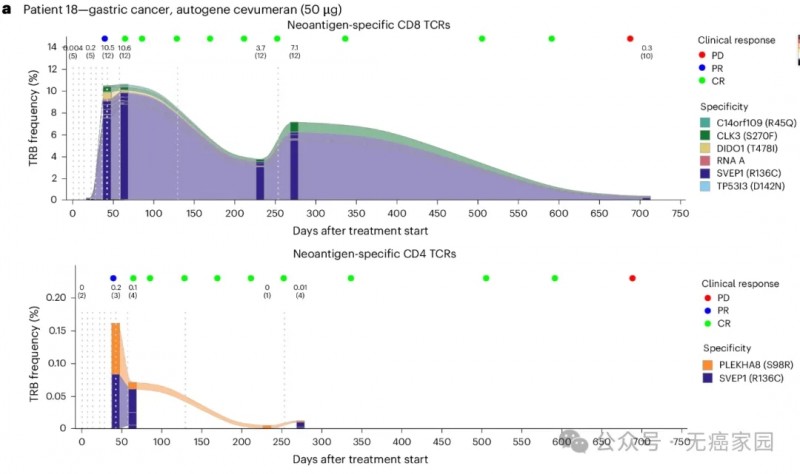
从患者 18 的纵向血液样本中分离的新抗原特异性 TCR
02、【直肠癌】
患者 21 患有微卫星稳定、PD-L1 低的直肠癌,在接受两线治疗后,肺部有 1.1 cm 靶病灶和非靶病灶,在接受 9 剂 38 µg 自体基因cevumeran和atezolizumab治疗后达到完全缓解,缓解持续时间为 8.2 个月,截至临床数据截止 3 年多后仍在研究中(随访 40.7 个月)。
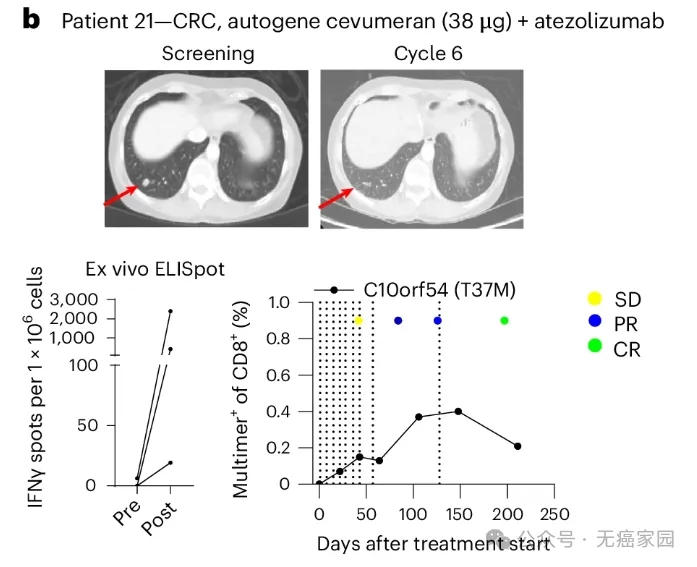
患有CRC的患者 21 的肺部 CT 扫描(顶部),通过体外 IFNγ ELISpot 检测到的对单个新抗原的 T 细胞反应强度(左下)和使用 pHLA 多聚体染色测定法对针对 C10orf54(T37M)的 CD8 +反应的时间过程分析(右下)
03、【三阴性乳腺癌】
患者 13 患有 PD-L1 高的三阴性乳腺癌(TNBC),在基于 nivolumab 的研究方案治疗后病情进展。在用 38 µg 自基因 cevumeran 和 atezolizumab 治疗后,患者出现确认的部分缓解,包括肺转移瘤大小减少,反应持续时间为 9.9 个月(29.9 个月随访)。
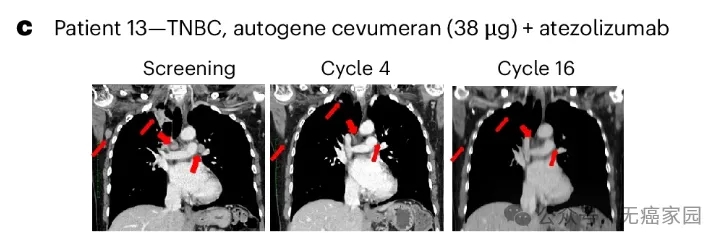
13号TNBC患者的肺部CT扫描(上排)和纵向CD8+反应动力学显示
04、【肾癌】
患者 38 患有肾癌,在入组前接受了包括 nivolumab 在内的四种全身治疗,最初在研究期间病情进展,但随后出现部分缓解。患者胸膜靶病变的最长直径总和(基线肿瘤)(SLD)为 108 mm,治疗 13 个月后减小到10 mm,即肿瘤显著缩小近10倍!
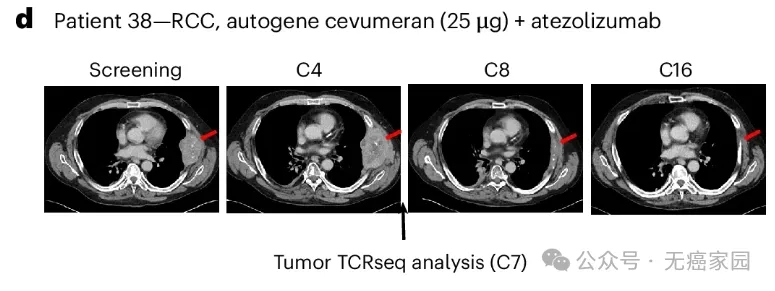
38号RCC患者的肺部CT扫描
此外,在近期一项关于胰腺导管腺癌 (PDAC)采用cevumeran疫苗辅助治疗的临床研究中,16例手术切除的PDAC患者接受了顺序辅助治疗——atezolizumab、cevumeran和mFOLFIRINOX化疗。
50%(8/16)的患者检测显示诱导出新抗原特异性T细胞。经过中位3年的随访,获得新抗原特异性免疫反应患者的无复发生存期(RFS)显著长于无疫苗激发免疫反应的患者。获得免疫反应组中位RFS尚未达到,未获得免疫反应组中位RFS为13.4个月。
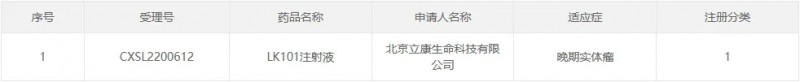
国内首个!肿瘤新生抗原mRNA疫苗-LK101注射液获FDA IND批准
2025年2月5日,我国研发的肿瘤新生抗原mRNA疫苗产品——LK101注射液成功获得美国食品药品监督管理局(FDA)的IND(临床试验申请)批准。这是中国首个在FDA获批的肿瘤新生抗原mRNA疫苗产品,标志着中国在肿瘤免疫治疗领域的创新实力得到了国际认可,也为全球癌症患者带来了新的希望。
值得一提的是,早在2023年3月15日,LK101注射液已经获得中国国家药品监督管理局药品审评中心(NMPA)的临床试验默示批准,用于治疗晚期实体瘤。
据获悉,这款产品是国内首个获批进入临床阶段的个性化肿瘤新生抗原疫苗,也是首个获批进入临床阶段的完全个性化的mRNA编辑产品,是国内mRNA肿瘤疫苗领域的里程碑事件。
图源NMPA官网
LK101注射液采用的是mRNA-DC(mRNA-树突状细胞)疫苗的形式,通过编码肿瘤新生抗原的mRNA体外转染树突细胞疫苗,兼具了mRNA疫苗和DC疫苗的优势。这款疫苗不仅安全性高、耐受性好,还能使患者获得长期的抗癌效应。
在2024年ASCO大会上,研究人员公布了LK101注射液治疗肝细胞癌(HCC)的首次人体临床研究的惊艳数据,初步证实了这款个性化的基于新抗原的 mRNA 负载树突状细胞疫苗与消融术相结合显著降低了肝细胞癌患者的复发率。

源自ascopubs官网
该试验共纳入24例 IIa 期HCC患者,分为疫苗接种组(LK101+消融联合治疗)和对照组(消融治疗),各12例。接种疫苗组中位随访时间为 48.4 个月,对照组为 38.8 个月。接种疫苗组1、2年复发率分别为18.2%、36.4%,均低于对照组的33.3%、51.4%;2、3年生存率分别为100%、100%,均高于对照组的83%、73%。
值得一提的是,接种疫苗组所有患者均存活,生存期均达4年以上。
该研究结果表明, LK101与消融疗法相结合具有可控的安全性,显示出免疫激活的证据和延长生存期的潜力。与常规消融相结合,基于新抗原的 mRNA 负载的DC疫苗是一种治疗 HCC 的有前途的免疫疗法。
如何寻求癌症疫苗治疗>>
若想寻求癌症疫苗或国内外治疗新技术帮助的患者,在经济条件允许的情况下,可以先将病理报告、治疗经历及出院小结等资料提交至医学部进行初步评估。
超3年无癌未复发!个体化癌症疫苗PCV成治疗肾细胞癌潜力股
2025年2月6日国际知名杂志《Nature》上刊登了国外研究学者们关于个性化癌症疫苗 (PCV)治疗肾细胞癌患者的最新研究成果。
其中,9例高风险、完全切除的透明细胞肾细胞癌 (RCC,III/IV 期) 患者在手术治疗后,采取靶向新抗原的 PCV治疗,在接种疫苗时同时使用或不使用伊匹单抗。在手术后中位随访40.2个月时,参与研究的9例患者中无一出现癌症复发,相当于超过3年均无癌症复发,且未观察到剂量限制性毒性。
该研究结果表明,高风险 RCC 中的新抗原靶向 PCV 具有高度免疫原性,能够靶向关键驱动突变并可诱导抗肿瘤免疫。这些观察结果,加上所有9例接种疫苗的患者均未出现复发,凸显了 PCV 作为 RCC 有效辅助疗法的前景。
基于新抗原的PCV具有将抗癌免疫反应导向癌细胞特异性表位的潜力,在杀死癌细胞的同时,避免免疫反应伤及健康细胞。PCV已经在临床试验中表现出抗癌潜力,例如,个体化新抗原疗法mRNA-4157与PD-1抑制剂Keytruda联用治疗经手术切除的高风险黑色素瘤患者的临床试验中,相对于单用Keytruda治疗,能够使患者复发或死亡风险降低49%,远处转移或死亡风险降低62%。
mRNA-4157-P201疫苗试验3年数据更新,有望2025年上市
在2024年美国临床肿瘤学会(ASCO)年会上,个体化新抗原疗法mRNA-4157(V940)联合Keytruda (帕博利珠单抗,pembrolizumab) 治疗已切除黑色素瘤:mRNA-4157-P201(KEYNOTE-942)试验的3年更新数据,其惊艳的研究数据使之有望成为首款上市的mRNA肿瘤疫苗,最早或将于2025年问世!
数据截止至2023年11月3日,在KEYNOTE-942研究中,数据显示,联合研发的基于患者肿瘤DNA的个体化治疗mRNA-4157/V940疫苗,显著改善了患者的无复发生存期(RFS),将高危III/IV期黑色素瘤患者的复发或死亡风险降低49%,远处转移或死亡风险降低62%。与单药组相比,联合治疗组的无远处转移生存期(DMFS)也得到了有临床意义的持续改善。
早在2024年AACR和ASCO已报道了此试验的初步数据,当时的报告中,中位随访时间约为2年,mRNA-4157和Keytruda联用可将复发或死亡风险降低44%,将远处转移或死亡风险降低65%。
mRNA-4157(V940)联合帕博利珠单抗的2.5年无复发生存率为74.8%,而单独使用帕博利珠单抗的2.5年无复发生存率为55.6%。联合治疗组和单药组的2.5年总生存(OS)率分别为96.0%和90.2%。
相较于单药组,联合治疗组在多个亚组人群中的RFS获益也得以维持,包括高肿瘤突变负荷(TMB),非高TMB,PD-L1阳性,PD-L1阴性和ctDNA阴性亚组。
总之,患者对mRNA-4157的耐受性良好,mRNA-4157+帕博利珠单抗联合治疗的安全性与先前分析一致,没有增强免疫相关不良事件。
再战告捷!BioNTech肿瘤疫苗联合PD-1单抗II期研究达到主要终点
2024年7月30日,BioNTech公布其进行中mRNA癌症疫苗BNT111的2期临床试验积极顶线数据。这次所公布的BNT111-01试验共纳入184例患者,接受为期最多24个月的治疗。分析显示,试验达成主要终点,BNT111与PD-1抑制剂Libtayo(cemiplimab)联合疗法能够显著改善无法切除的晚期黑色素瘤患者的总缓解率(ORR)。公司预定继续进行试验,以进一步评估尚未成熟的次要终点。

图源来自BioNTech官网
此前,2021 年,BNT111 与 cemiplimab 联合使用获得FDA快速通道认定,用于治疗抗 PD-1 难治/复发、不可切除的 III 期或 IV 期黑色素瘤。同年,FDA 授予 BNT111 孤儿药认定,用于治疗 IIB 期至 IV 期黑色素瘤,旨在为晚期黑色素瘤患者带来新的希望。
肿瘤抗原mRNA疫苗通过激活对特定肿瘤抗原的特异性免疫细胞来杀伤表达这些抗原的肿瘤细胞。而PD-1抗体等免疫检验点属于非特异性的接触免疫逃逸,能够重新调动免疫细胞杀伤肿瘤细胞。两者在机制上具有互补的效应,联合治疗这种1+1>2的想法在此得到印证,抗癌就像打群架,一个人干不过就多找几个帮手。
BioNTech开发的BNT111疫苗是一种mRNA癌症疫苗,通过静脉注射的方式输入患者体内,可编码四种黑色素瘤相关抗原,即酪氨酸酶、NY-ESO-1(纽约食管鳞状细胞癌1)、MAGE-A3(黑色素瘤相关抗原A3)、TPTE(张力蛋白同源跨膜磷酸酶)。
在1期临床试验中共纳入了56例患者,其中30例患者接受BNT111单独治疗,另26例患者接受BNT111与PD-1单抗的联合治疗。结果显示,联合治疗组有完全缓解6例,病情稳定2例,疾病进展9例,优于BNT111单药组(25例可评估患者中有完全缓解1例,部分缓解3例,疾病稳定7例,疾病进展14例)。此外,数据显示BNT111疫苗安全性良好,常见副作用为轻至中等程度的发热、自觉寒冷等表现,通常在治疗后的24小时内自行缓解。
小编有话说
迄今为止,在美国国立卫生研究院(National Institutes of Health,NIH)临床试验的网站上可以查到总共有 7 000 多种肿瘤疫苗处于研发阶段,其中 mRNA疫苗有 640 个,涉及新抗原的疫苗有 197 个,进入临床的 mRNA 疫苗涉及免疫调节的疫苗 7 个,TAA 抗原 11 个和新抗原 10 个,大部分处于Ⅰ/Ⅱ期临床试验。随着mRNA 肿瘤疫苗新抗原和靶向抗原TAA 在 AI 辅助下的研发,抗原设计更加智能化, 靶向细胞和组织的递送系统更加成熟,mRNA 肿瘤疫苗获得临床批准的可能性越来越大,预计在未来几年中将会有多款 mRNA 肿瘤疫苗进入临床治疗的应用阶段。
目前,肿瘤疫苗临床试验正在如火如荼地开展,在不同肿瘤类型中取得疗效突破的好消息也不断传来。新型肿瘤疫苗(个性化新抗原疫苗、树突细胞疫苗、mRNA疫苗、DNA疫苗等)已经在延长晚期实体瘤患者生存期方面展现了不错的实力。
参考文献
1.https://www.nature.com/articles/s41591-024-03334-7
2.https://www.nature.com/articles/s41586-024-08507-5#Bib1
3.https://www.vaticannews.va/en/world/news/2023-10/nobel-medicine-covid-vaccine-kariko-weissman.html
4.https://www.nature.com/articles/s41586-023-06063-y
5.https://www.mskcc.org/annual-report/2021/brighter-outlook-pancreatic
6.https://www.genengnews.com/topics/cancer/vaccine-boosts-car-t-cell-therapy-for-solid-tumors/
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐

4个月婴儿确诊致命脑瘤被判死刑,革命性抗
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

胰腺癌实现完全缓解!2026癌症疫苗,T
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
22款肺癌新药扎堆上市!2026这些基因
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
66.7%显著缩小 + 60周持续完全缓
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
"打一针"实现长期生
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

国研双抗突破实体瘤困局!首次人体研究结果
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




