2025 CAR-T 11项里程碑进展全盘点:7款获批+首个处方落地,90.6%高缓解率解锁抗癌新篇
2025年CART细胞疗法11项里程碑进展全盘点:7款获批+首个处方落地,90.6%高缓解率解锁抗癌新篇
CAR-T细胞疗法历经数十年发展,已成为肿瘤免疫细胞治疗领域的核心支柱,其在血液肿瘤治疗中斩获的成果有目共睹。这一疗法的问世不仅打破了传统肿瘤治疗模式,更推动肿瘤免疫疗法成为继手术、放疗、化疗之后的第四大肿瘤治疗手段。
2025年堪称CAR-T疗法的爆发之年,国内外多款新产品或新适应症密集获批,并在多个癌种治疗中取得突破性进展;我国更是有5款CAR-T产品成功纳入国谈商保目录,大幅提升了治疗可及性。接下来,小编将为癌友们盘点2025年CAR-T治疗领域的关键进展,以供参考。
2025 CAR-T领域11大进展全面盘点:7款获批+20万一针刷新价格洼地+5款首入医保商保
雷尼基奥仑赛注射液:国产第4款CD19CAR-T获批
雷尼基奥仑赛注射液(HR001,商品名:恒凯莱®)是恒润达生研发的一款靶向CD19CAR-T细胞疗法,于2025年7月30日获国家药品监督管理局(NMPA)批准上市。其适应症为成人经二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤——这是非霍奇金淋巴瘤中最常见的亚型,具体包括弥漫性大B细胞淋巴瘤非特指型、滤泡性淋巴瘤转化的弥漫性大B细胞淋巴瘤、伴MYC和BCL2重排的高级别B细胞淋巴瘤、高级别B细胞淋巴瘤非特指型。该药也是我国第4款获批的CD19CAR-T细胞疗法。

▲截图源自“NMPA”
早在2024年美国癌症研究协会(AACR)大会上,恒润达生就公布了该药治疗复发/难治性非霍奇金淋巴瘤(R/RNHL)的2期临床试验(HRAIN01-NHL01-II)的振奋数据。
结果显示:患者中位无进展生存期(PFS)为176天(95%CI:91-NE),总生存期(OS)尚未达到;中位缓解持续时间(DOR)为339天(95%CI:149-NE),最佳缓解中位时间为30天(范围:28-358天)。客观缓解率(ORR)方面,3个月、6个月及最佳时点分别为53.1%(95%CI:41.7~64.3)、45.7%(95%CI:34.6~57.1)、74.1%(95%CI:63.1~83.2);完全缓解率(CRR)在上述三个时点则分别为32.1%(95%CI:22.2~43.4)、29.6%(95%CI:20.0~40.8)、49.4%(95%CI:38.1~60.7)。
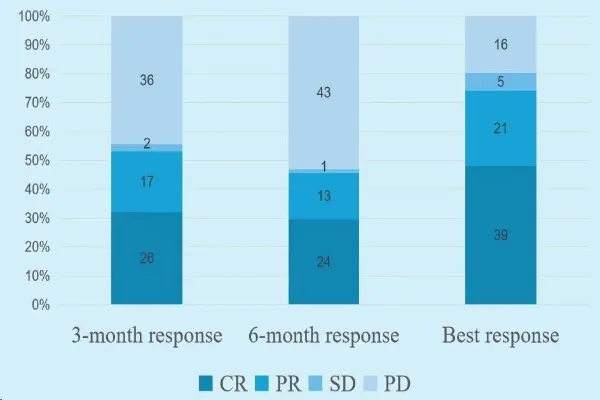
▲图源“AACR”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
纳基奥仑赛注射液:新适应症获批上市
纳基奥仑赛注射液(商品名:源瑞达®,通用名:Inaticabtagene Autoleucel Injection,曾用名:CNCT19细胞注射液)是合源生物自主研发的中国首款靶向CD19CAR-T细胞治疗产品,于2025年11月28日获中国国家药品监督管理局(NMPA)正式批准新适应症,用于治疗经二线及以上系统性治疗后复发或难治性大B细胞淋巴瘤(r/rLBCL)。这是该产品在中国的第二项上市批准,也是国内目前唯一覆盖白血病与淋巴瘤两大血液肿瘤领域的CAR-T产品。

▲截图源自“合源生物官网”
《癌症免疫治疗杂志》报道了“纳基奥仑赛(CNCT19)联合高剂量化疗/自体干细胞移植(HDT/ASCT),治疗r/rLBCL”的I/II期临床试验振奋数据。结果显示:最佳客观缓解率(ORR)达92.0%(95%CI:74.0%-99.0%),最佳完全缓解率(CR)为72.0%(95%CI:50.6%-87.9%)。
值得一提的是,2025年5月30日,中山大学附属第一医院贵州医院/贵州医科大学附属医院已开展贵州省首例纳基奥仑赛CAR-T疗法治疗,为一名陷入“无药可用”绝境的23岁复发难治性急性淋巴细胞白血病(r/r B-ALL)患者完成细胞回输,填补了省内该类疾病精准免疫治疗的空白。

利基迈仑赛(Breyanzi):FDA和欧盟相继获批
利基迈仑赛(商品名:Breyanzi,通用名:lisocabtagene maraleucel,简称liso-cel)是百时美施贵宝研发的一款自体靶向CD19 CAR-T细胞疗法。
2025年11月25日,该药获欧盟委员会批准,用于治疗至少接受过两线系统性治疗(含BTK抑制剂)后复发/难治性套细胞淋巴瘤(MCL)的成年患者。仅时隔10天(2025年12月4日),,利基迈仑赛再获美国食品药品监督管理局(FDA)批准新适应症,用于至少接受过两线系统治疗的复发性或难治性边缘区淋巴瘤(MZL)成年患者。这一获批使其成为全球首个且目前唯一针对该适应症的CAR-T细胞疗法,成功填补了MZL治疗领域的空白。
本次FDA新适应症的获批,主要基于TRANSCENDFLII期试验(NCT04245839)中MZL队列的振奋数据。结果显示,在意向治疗人群中,患者总缓解率(ORR)达84.4%(95%CI:74.4%-91.7%),完全缓解率(CR)为55.8%(95%CI:44.1%-67.2%),中位缓解持续时间(DOR)尚未达到(NR;95%CI:25.59-NR),疗效显著且持久。
▲截图源自“FDA”
瑞基奥仑赛:中国首个拥有三款适应证的CAR-T产品,新适应症申报上市
瑞基奥仑赛注射液(通用名:relmacabtagene autoleucel,简称relma-cel;商品名:倍诺达®、Carteyva®)是药明巨诺研发的一款靶向CD19CAR-T细胞治疗产品,不仅是中国首个获批用于治疗复发或难治性套细胞淋巴瘤(r/rMCL)的CAR-T疗法,也是国内首个拥有三款适应症的CAR-T产品,更是中国首个覆盖三大癌种适应症的CAR-T标杆产品。
2025年5月24日,该药正式向国家药监局药品审评中心(CDE)提交第四项适应症上市申请,拟用于一线治疗失败后不适合大剂量化疗与自体干细胞移植的成人复发/难治性侵袭性B细胞非霍奇金淋巴瘤(r/r B-NHL)的治疗,标志着其向第四项适应症发起冲刺。
全球知名期刊《Nature》子刊《骨髓移植》曾发表“瑞基奥仑赛注射液治疗复发/难治性(R/R)B细胞非霍奇金淋巴瘤(B-NHL)”的I期临床试验长达2年的随访数据。结果显示,在20例可评估疗效的患者中,客观缓解率(ORR)高达85.0%,最佳完全缓解率(CRR)达75.0%,2年无进展生存率(PFS率)为60.0%,2年总生存率(OS率)达70.0%。
▲截图源自“NMPA”
布瑞基奥仑赛:中国申报上市,白血病MRD阴性率达100%
布瑞基奥仑赛注射液(通用名:Brexucabtagene autoleucel,简称Brexu-cel,商品名:Tecartus、KTE-X19)是复星凯瑞研发的一款自体抗CD19 CAR-T细胞疗法。2025年9月24日,中国国家药品监督管理局药品审评中心(CDE)官网显示,该药已申报上市,拟用于治疗成人复发/难治性前体B细胞急性淋巴细胞白血病。
值得一提的是,该药此前已在美国、欧盟、加拿大等多个国家和地区获批,适应症涵盖套细胞淋巴瘤与B细胞急性淋巴细胞白血病(B-ALL)。此次国内申报进展,意味着中国相关白血病患者有望更快触达国际前沿治疗方案,为众多期盼新生的家庭点亮希望。

▲截图源自“NMPA”
2025年6月,布瑞基奥仑赛在中国复发/难治性B前体急性淋巴细胞白血病(R/R B-ALL)患者中的II期桥接注册临床研究(ChiCTR2300073872)最新数据公布。结果显示:总体完全缓解(CR)/不完全血液学恢复的完全缓解(CRi)率达78.6%(90%CI:62.0%,90.2%)(详见下图);中位无复发生存期(RFS)与中位缓解持续时间(DOR)暂无法估计;所有应答者的微小残留病(MRD)均为阴性(100%)。
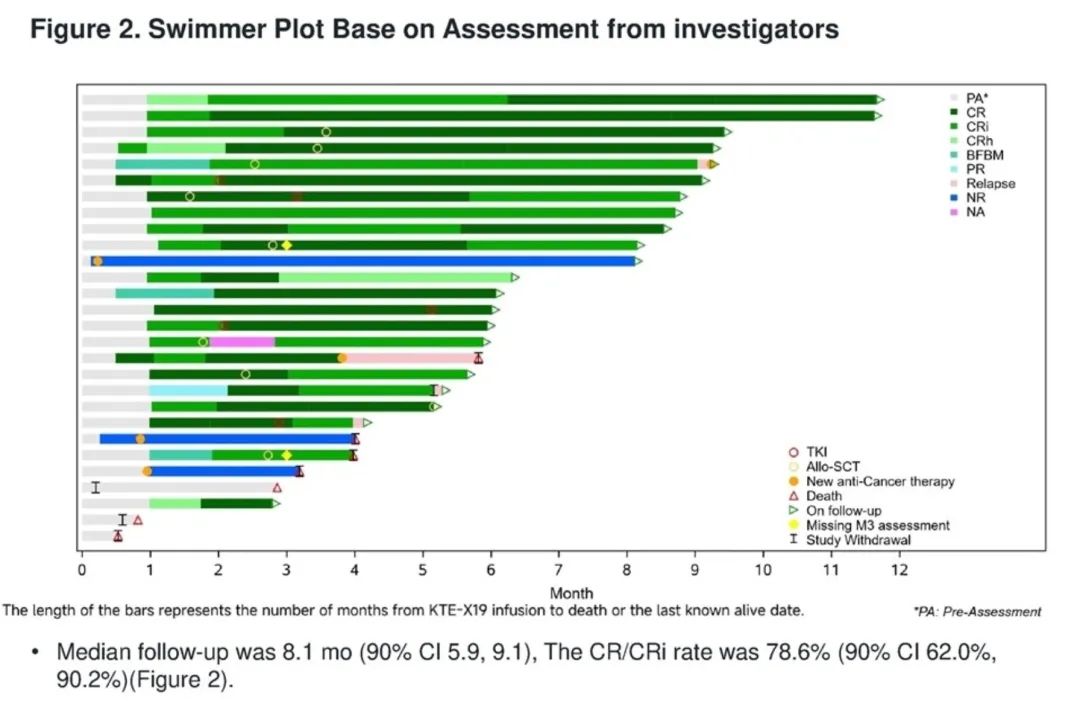
普基奥仑赛注射液:中国首款儿童白血病CD19 CAR-T获批
普基奥仑赛注射液(研发代码pCAR-19B,商品名:普利得凯®)是一款自体CAR-T细胞产品,核心优势在于优化的人源化CD19特异性单链可变区片段(scFv),专为提升治疗安全性设计。
2025年11月7日,国家药品监督管理局(NMPA)通过优先审评审批程序,附条件批准重庆精准生物申报的普基奥仑赛注射液上市,适用于3~21岁CD19阳性的难治或复发急性B淋巴细胞白血病(首次缓解12个月后复发的患者需先接受挽救化疗)的治疗,实现了中国儿童及青少年r/rB-ALL适应症CAR-T领域“零的突破”。
国际知名期刊《Blood》发表了“普基奥仑赛针对中国复发/难治性B细胞急性淋巴细胞白血病(r/rB-ALL)儿童和青少年患者的关键性II期临床试验(NCT05334823)”的振奋数据,该研究也是首个聚焦亚洲人群儿童B-ALL的关键性临床试验。
结果显示:最佳客观缓解率(ORR)达90.63%(58/64),其中78.13%(50/64)实现完全缓解(CR),12.5%(8/64)达到伴不完全血细胞恢复的完全缓解(CRi),疗效优于已上市的同类抗CD19CAR-T疗法;98.27%(57/58)的缓解患者达到微小残留病(MRD)阴性。此外,患者3个月时ORR为76.56%(49/64),中位缓解持续时间(DOR)达10.61个月(95%CI:7.66-20.96),中位总生存期(OS)为23.92个月(95%CI:9.86-未达到)。
▲截图源自“NMPA”
雷尼基奥仑赛:国产首款治疗r/r LBCL的CAR-T疗法
雷尼基奥仑赛注射液(商品名:恒凯莱®,HICARA®)是恒润达生自主研发的CD19靶向CAR-T细胞产品,兼具两大重要身份——它不仅是首款国产治疗复发或难治性大B细胞淋巴瘤(r/rLBCL)的CAR-T药物,也是首款获批采用稳转细胞株病毒工艺的国产CAR-T产品。
2025年7月30日,该药获中国国家药品监督管理局正式批准上市,适应症为经过二线或以上系统性治疗后,成人复发或难治性大B细胞淋巴瘤,具体包括弥漫性大B细胞淋巴瘤非特指型、滤泡性淋巴瘤转化的弥漫性大B细胞淋巴瘤、伴MYC和BCL2重排的高级别B细胞淋巴瘤、高级别B细胞淋巴瘤非特指型。
▲截图源自“NMPA”
此次获批基于关键II期临床试验(HRAIN01-NHL01-II)的振奋数据:该研究纳入81例基线ECOG评分0-1分的复发/难治性非霍奇金淋巴瘤(R/RNHL)患者,接受雷尼基奥仑赛(代号HR001)输注治疗后,中位随访时间达160天(范围7~454天)。
结果显示:患者3个月、6个月及最佳客观缓解率(ORR)分别为53.1%(95%CI:41.7-64.3)、45.7%(95%CI:34.6-57.1)、74.1%(95%CI:63.1-83.2);3个月、6个月及最佳完全缓解率(CRR)分别为32.1%(95%CI:22.2-43.4)、29.6%(95%CI:20.0-40.8)、49.4%(95%CI:38.1-60.7);中位缓解持续时间(DOR)为339天(95%CI:149-NE),中位无进展生存期(PFS)为176天(95%CI:91-NE)。
值得一提的是,雷尼基奥仑赛已实现从临床试验到处方落地,复旦大学附属中山医院血液科作为其注册临床试验的组长单位,全程主导并深度参与研究,见证了该药从临床研究到商业化落地的每一个关键里程碑。

HD CD19 CAR-T细胞药物:递交上市申请,20万一针击穿CAR-T价格底线
2025年12月12日,华道生物自主研发的HD CD19 CAR-T细胞药物,正式向国家药品监督管理局药品审评中心(CDE)递交上市申请。这是该企业首款针对难治或复发非霍奇金淋巴瘤的CAR-T治疗药物,截至目前,该药已获批两项临床适应症,分别为治疗难治或复发的非霍奇金淋巴瘤与B细胞急性淋巴细胞白血病。
更令人振奋的是,这款拥有完全自主知识产权的“中国造”细胞药物,有望将此前动辄百万元的CAR-T治疗费用大幅降至20余万元区间,既显著降低患者用药门槛,更让曾经“高不可攀”的精准治疗真正贴近普通患者。

▲截图源自“NMPA”
舒瑞基奥仑赛:全球首个实体瘤CAR-T
舒瑞基奥仑赛注射液(satri-cel,Satricabtagene autoleucel,CT041)是科济药业研发的一款自体CLDN18.2CAR-T细胞疗法。2025年5月20日,该药被中国国家药监局药品审评中心(CDE)纳入优先评审,拟用于CLDN18.2表达阳性、经至少二线治疗失败的晚期胃/食管胃结合部腺癌治疗。这一进展使其有望成为全球首款上市的实体瘤CAR-T产品,为攻克实体瘤治疗难题带来历史性突破。

▲截图源自“NMPA”
2025年美国临床肿瘤学会(ASCO)年会公布了舒瑞基奥仑赛注射液的多项关键数据,随机对照试验成果同步发表于《柳叶刀》杂志。
结果显示:根据独立审查委员会评估,satri-cel组较标准治疗组(TPC)在无进展生存期和总生存期方面获益显著:中位无进展生存期(PFS)为3.25个月(95%CI:2.86–4.53),远高于TPC组的1.77个月(95%CI:1.61–2.04)。中位总生存期(OS)达7.92个月(95%CI:5.78–10.02),较TPC组的5.49个月(95%CI:3.94–6.93)提升超30%。此外,satri-cel组确诊客观缓解率为22%(23/104,95%CI:15–31)、疾病控制率为63%(95%CI:52–72),而TPC组这两项数据仅为4%(2/52,95%CI:0–13)和25%(95%CI:14–39),疗效优势十分明显。
其中一个典型案例引发广泛关注:患者输注satri-cel后第2周肝脏病灶虽较基线增大,但后续随访中持续缩小,至第26周已小于基线水平,直观印证了该疗法的持续抗肿瘤活性。
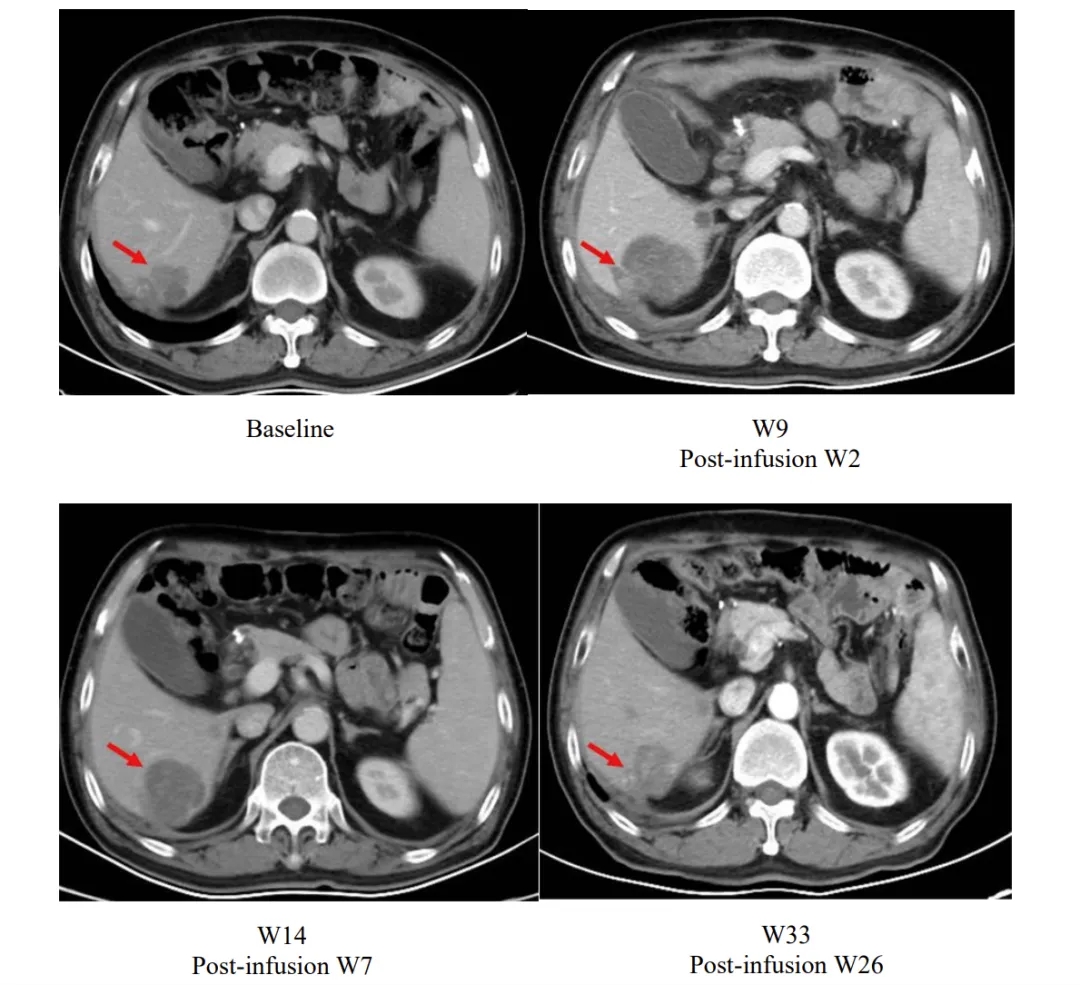
▲图源“The Lancet”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
ESO-T01:武汉协和完成全球首个体内CAR-T治疗
ESO-T01是实现体内制备CAR-T疗法的关键载体,这是一种靶向纳米抗体的免疫屏蔽慢病毒载体,含有人源化抗B细胞成熟抗原(BCMA)单域抗体嵌合抗原受体(CAR),专门用于体内T细胞工程改造,且已在临床前研究中展现出良好的安全性和有效性。
2025年7月2日,武汉协和医院血液科团队在国际医学顶刊《柳叶刀(TheLancet)》发表一项革命性研究,成为全球首个报道“体内制备CAR-T细胞治疗复发/难治多发性骨髓瘤”取得临床成功的研究。该研究基于ESO-T01载体的体内制备CAR-T疗法,针对复发或难治性多发性骨髓瘤患者开展首次人体试验(NCT06691685)。
结果显示:接受ESO-T01治疗后,患者疗效显著。患者1在治疗第2个月达到严格意义上的完全缓解(CR),所有髓内和髓外病变均消退(详见下图B);患者2在第28天达到严格完全缓解,病变完全消退(详见下图D);患者3和4达到部分缓解(PR),至第28天肿瘤病变缩小,骨髓中微小残留病灶转阴。
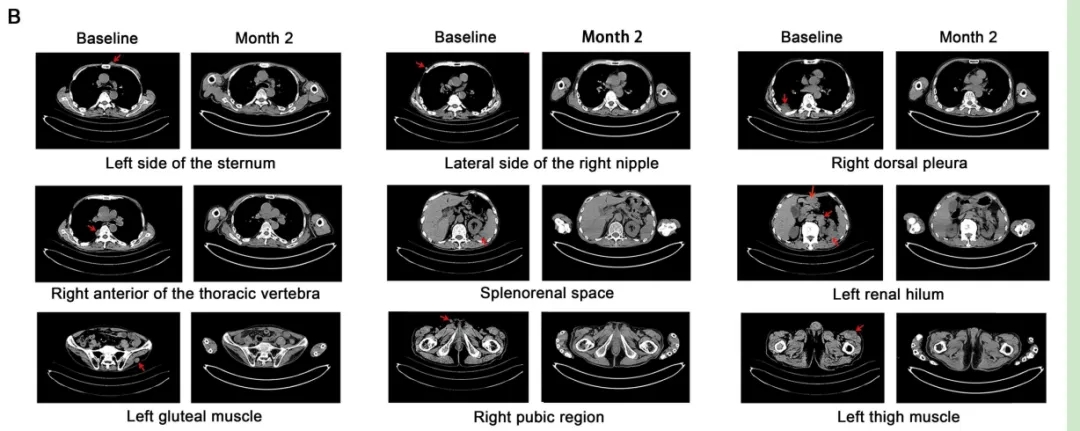
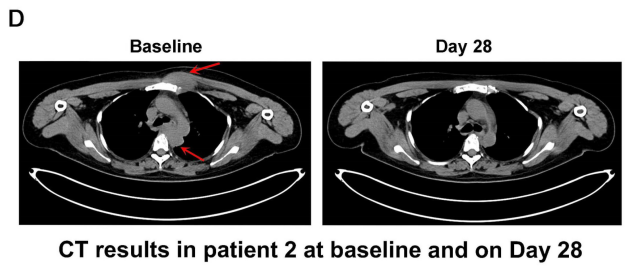
▲图源“Lancet”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
5款CAR-T疗法全部纳入2025首版商保创新药品目录
2025年10月30日,正式开启了第八次国家医保药品目录谈判(简称“国谈”),本次调整的最大突破在于首次增设商保创新药目录。
据悉,在国内已获批上市的7款CAR-T产品中,有5款参与了商保创新药目录申报(其中3款同步申报基本医保),具体为复星凯特的阿基仑赛、药明巨诺的瑞基奥仑赛、驯鹿生物的伊基奥仑赛、恺兴生命的泽沃基奥仑赛及合源生物的纳基奥仑赛。这5款产品每针价格区间为99万-129万元,且均已通过国谈前专家评审(详见下表)。
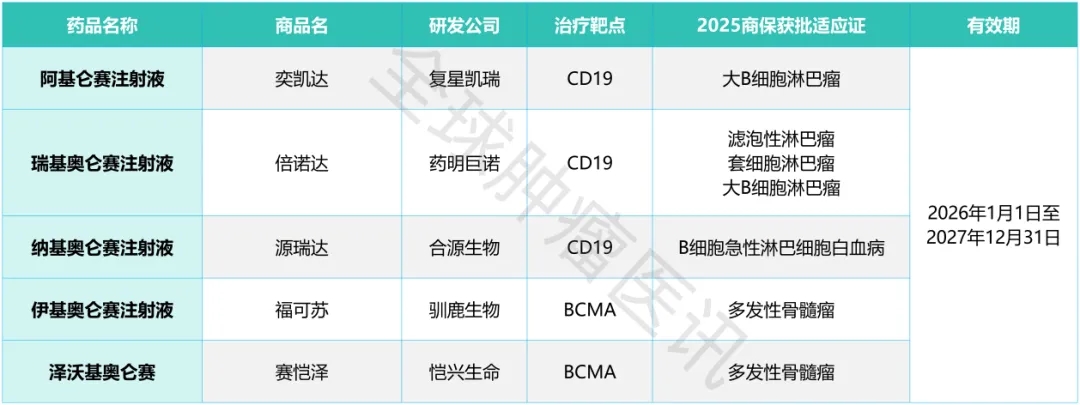
▲数据源自“医保局官网”,医学部整理汇总
小编寄语
CAR-T细胞疗法在血液系统恶性肿瘤的治疗领域已取得突破性进展,众多患者从中受益。令人欣慰的是,近年来全球的研究人员从未停止探索的脚步,持续钻研各种新型策略,致力于降低肿瘤抗原异质性,打破免疫抑制的困境,并在胃癌、脑瘤、胰腺癌、肝癌、结直肠癌等实体瘤领域取得了突破性进展!
好消息是,中国已成功研发出多款针对多款血液肿瘤及实体瘤的CAR-T疗法,并在国内多家知名癌症中心启动临床,想明确自身靶点或寻求CAR-T等新型疗法帮助的患者,可将完整的病理报告、治疗经历等资料,提交至医学部,进行初步评估或了解详细的入排标准。
参考资料
[1]Ying Z,et al.Efficacy and safety of relmacabtagene autoleucel, an anti-CD19 chimeric antigen receptor T cell, in relapsed/refractory B-cell non-Hodgkin’s lymphoma: 2-year results of a phase 1 trial[J]. Bone Marrow Transplantation, 2023, 58(3): 288-294.
https://www.nature.com/articles/s41409-022-01888-z
[2]Qi C,et al. Claudin-18 isoform 2-specific CAR T-cell therapy (satri-cel) versus treatment of physician's choice for previously treated advanced gastric or gastro-oesophageal junction cancer (CT041-ST-01): a randomised, open-label, phase 2 trial[J]. The Lancet, 2025, 405(10494): 2049-2060.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(25)00860-8/abstract
[3]Xu J,et al.In-vivo B-cell maturation antigen CAR T-cell therapy for relapsed or refractory multiple myeloma[J]. The Lancet, 2025.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(25)01030-X/fulltext
[4]http://www.news.cn/health/20240412/5b0f8f4e49be4c44a89a769f173e5e20/c.html
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐

4个月婴儿确诊致命脑瘤被判死刑,革命性抗
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

胰腺癌实现完全缓解!2026癌症疫苗,T
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
22款肺癌新药扎堆上市!2026这些基因
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
66.7%显著缩小 + 60周持续完全缓
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
"打一针"实现长期生
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

国研双抗突破实体瘤困局!首次人体研究结果
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




