抗癌新药井喷!EGFR、KRAS、NTRK等靶点迎来突破进展,这些肿瘤患者有药用了!
2025年靶向药新药井喷!EGFR、KRAS、NTRK等靶点迎来突破进展,这些肿瘤患者有药用了
数十款靶向药物横扫各类癌症,中国研发力量贡献近半创新成果,肿瘤治疗正进入精准打击新时代!
肺癌晚期患者王女士的耐药噩梦终于迎来转机——在接受第四代EGFR抑制剂DZD6008临床试验治疗后,她脑部转移灶缩小了40%,且治疗持续有效时间已超过6个月。三年前,当第三代EGFR靶向药开始失效时,她几乎陷入绝望:“医生说我可能只剩几个月的时间,但如今新药让我能看着儿子小学毕业。”王女士的经历并非孤例。
2025年,全球抗癌药物研发迎来了前所未有的爆发期。从第四代EGFR抑制剂突破血脑屏障,到KRAS“不可成药”神话的彻底终结,再到CAR-T疗法在实体瘤领域的重大突破,科学家们以前所未有的速度攻克着一个又一个治疗难题。
目前,癌症靶向治疗进展非常迅速,无论是国内外,均有不少高效的靶向药纷纷获批上市或投入使用,涵盖多样癌种,更是横扫众多热门靶点NTRK、EGFR、KRAS G12C、Claudin 18.2等。今天,小编就给大家介绍这些国内外掀起风暴的抗癌药。
EGFR靶点:第四代药物突破耐药与血脑屏障
肺癌治疗领域最令人振奋的突破来自第四代EGFR抑制剂。耐药性和脑转移这两大临床痛点正被新一代药物逐步瓦解。
破解肺癌耐药困境,迪哲医药第四代EGFR TKI亮相ASCO
2025年ASCO年会上,迪哲医药研发的DZD6008在TIAN-SHAN2临床研究中展现出多重优势。这项多中心I/II期研究纳入了曾接受EGFR抑制剂治疗失败的晚期患者,其中50%的患者ECOG评分为1分,所有人都经历过中位5线的既往治疗。
最新数据令人瞩目:
1.在剂量递增阶段(20-90mg/日),83.3%(10/12)的患者靶病灶缩小;
2.不同EGFR突变类型患者使用≥20mg剂量均观察到部分缓解;
3.脑转移患者中同样观察到抗肿瘤活性,最长治疗持续时间超过6个月且仍在持续
穿透血脑屏障的能力是DZD6008的核心突破。研究证实,在基线存在脑转移的患者中,其脑脊液与游离血浆浓度比例>1,实现完全穿透。这一特性解决了肺癌脑转移患者长期缺乏有效治疗手段的困境。
好消息是,目前DZD6008正有全国多中心的临床招募,主要针对EGFR三代药耐药的肺癌患者,EGFR TRI耐药,或者一线化疗失败的患者均有机会参加,可联系医学部评估病理报告。
疾病控制率近90%!赛沃替尼+奥希替尼联合疗法国内获批新适应症
几乎所有患者最终都会对奥希替尼产生耐药,最常见的耐药机制包括MET扩增和EGFR耐药突变。针对上述耐药突变,和黄医药的赛沃替尼联合奥希替尼在SACHI III期研究中取得突破性成果。2025年6月30日,NMPA官网显示,和黄医药的赛沃替尼在国内获批一项新适应症,与奥希替尼联用,治疗伴有MET扩增的接受一线EGFR抑制剂治疗后疾病进展的EGFR 突变阳性局部晚期或转移性非小细胞肺癌。

图源NMPA官网
截止日2024年8月30日,211例患者被随机分配为赛沃替尼+奥希替尼联合治疗或化疗治疗。
研究结果显示:
1.在意向治疗(ITT)人群中,研究者评估的联合治疗组中位PFS较化疗组显著延长(8.2个月 vs 4.5个月);独立审查委员会 (IRC) 评估的联合治疗组中位PFS也较化疗组显著延长(7.2个月 vs 4.2个月);
2.客观缓解率(ORR):研究者评估的联合治疗组 vs 化疗组为58% vs 34%;
3.疾病控制率(DCR)为89% vs 67%;中位缓解持续时间 (DoR) 分别为 8.4 个月和 3.2 个月。
此外,赛沃替尼作为单药疗法或与其他药物的联合疗法,正开发用于治疗包括肺癌、肾癌和胃癌在内的多种肿瘤类型,为EGFR耐药患者提供了新的希望。
肺癌领域创新突围!全球双抗ADC iza-bren治疗EGFR突变患者疗效惊艳
2025年ASCO年会上,当中国团队公布全球首个EGFR/HER3双抗ADC药物iza-bren(BL-B01D1)在肺癌治疗中的突破性数据时,会场响起热烈掌声——69.2%的客观缓解率在曾被认为“无药可治”的EGFR外显子20插入突变患者中实现,专家惊叹“这是改变临床实践的时刻”。
该研究共纳入83例患者,包括携带EGFR20外显子插入突变/非经典EGFR突变、HER2突变、KRAS/BRAF/MET 突变、ALK/ROS1/RET/NTRK 融合的患者分别为 14 例、19 例、26 例和 24 例。
研究结果显示,iza-bren显示出极具前景的抗肿瘤活性,整体客观缓解率(ORR)达46.2%,确认ORR为39.7%,疾病控制率(DCR) 85.9%,中位无进展生存期(PFS)为7个月,中位缓解持续时间和中位总生存期均未达到。
此外,研究表明 iza-bren 在经治经典 EGFR 突变外驱动基因变异 NSCLC 患者中具有较好的抗肿瘤活性和生存获益,特别是EGFR20外显子插入突变/非经典 EGFR 突变患者中,ORR高达69.2%,中位 PFS 达到 10.5 个月,结果令人振奋。
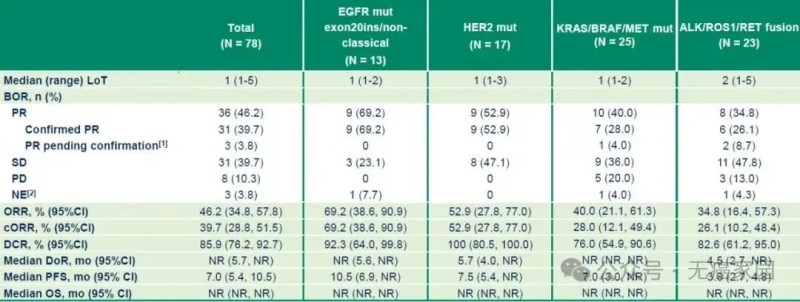
图为所有患者初步疗效
闪耀国际!Zipevalinib在EGFR ex20ins NSCLC治疗中初见成效
一个基因会有多种不同类型的突变,EGFR突变也不例外,其中突变最高的EGFR外显子19缺失和L858R突变较为典型,加起来可达90%,其他的罕见突变约占10%左右,其中EGFR外显子20插入突变(EGFR ex20ins)就属于罕见突变范畴。
Zipevalinib(齐帕勒替尼,研发代号:CLN-081, TAS6417)是一种新型EGFR TKI,在一项针对铂类化疗(plt-chemo)后进展的晚期或转移性EGFR ex20ins突变NSCLC患者进行的1/2a期研究中显示出良好的临床活性和可控的安全性。
截止到2024年12月10日,在所有接受治疗的患者中,Zipevalinib显示出确认的客观缓解率 (cORR) 为35.2% ,中位缓解持续时间 (mDoR) 为8.8个月,中位无进展生存期 (mPFS) 为9.5个月。
在所有脑转移的患者中,全身的cORR为30.9%。不良反应多为1~2级,安全可控,这为患者提供了新的治疗选择。
瞄准EGFR/HER2 exon20ins突变,中国药研研发抗癌创新药NIP142横空出世
NIP142是中国药研研发并具有全球自主知识产权的I类小分子创新药,通过抑制EGFR或HER2 exon20ins突变体活性,阻断下游信号通路活化,进而达到抑制肿瘤增长的目的。在已完成的一系列非临床研究中,NIP142作为强效、高选择性EGFR/HER2 exon20ins抑制剂,对多种移植瘤模型表现出优异的抗肿瘤活性,且耐受性良好。与同机制药物EXKIVITY(通用名:Mobocertinib,代号:TAK-788)相比,NIP142具有更优的药代动力学性质,以及更大的安全窗口,有潜力成为EGFR/HER2 exon20ins突变NSCLC新的治疗选择。
NIP142作为中国药研首个获批临床试验的抗肿瘤创新药,是中国药研抗肿瘤研发管线建设的重要里程碑。
如何尝试EGFR相关突变的抗癌新药>>
目前全球针对EGFR ex20ins突变及其他EGFR相关突变的众多新药研发正在如火如荼地进行当中,如伏美替尼、NIP142、plb1004、舒沃替尼、HSK40118、SYS6010、DZD6008、A303等等!
想要参加的患者可提交病理报告、治疗经历、出院小结等资料至医学部初步评估病情。
KRAS靶点:从"不可成药"到全面围剿
KRAS是实体瘤中最常见的癌基因之一,大约30%的肿瘤都存在KRAS突变,包括90%的胰腺癌,30%~40%的结肠癌和15%~20%的肺癌。然而,KRAS靶向药却寥寥无几,KRAS一度成为无药可用的最难突变。就在2025年,曾经被称为“不可成药”靶点的KRAS,如今已迎来全面突破!
疾病控制率91%!针对KRAS G12D的GFH375力破胰腺癌、肺癌等实体瘤
2025年ASCO年会上,劲方医药的GFH375(VS-7375)数据引发全球关注——这款针对KRAS G12D突变的口服抑制剂展现出惊人疗效。
I期试验中有62例经治晚期KRAS G12D突变实体瘤患者入组。
截至数据截止日,49例患者接受日均剂量为400或600mg的口服治疗:
●其中43例患者接受过至少一次治疗后肿瘤评估,总体客观缓解率(ORR)为42%、疾病控制率(DCR)为91%;
●23例可评估的胰腺导管腺癌(PDAC)患者ORR达52%,DCR为100%;
●12例可评估非小细胞肺癌患者的ORR达42%,DCR为83%;
●中位治疗持续时间11.8周,中位反应时间6.2周;
尤其值得关注的是,75%的患者入组时已接受过二线及以上治疗,且98%存在转移(53%肝转移,21%骨转移),凸显了该药在高度难治人群中的价值。
截至数据截止日,52例患者完成至少一次治疗后肿瘤评估,所有剂量组患者的ORR为38%,DCR为90%;其中38例患者靶病灶缩小、20例患者达到部分缓解。
研究初步显示了GFH375的良好口服生物利用度,对PDAC等实体瘤患者、以及多线治疗后疾病进展的患者展现了显著的抑瘤活性。
国内上市!戈来雷塞攻下KRAS G12C非小细胞肺癌堡垒
2025年5月22日,戈来雷塞(glecirasib,JAB-21822,艾瑞凯,格来雷塞)正式获得中国国家药品监督管理局(NMPA)批准,用于至少接受过一种系统性治疗的KRAS G12C突变型晚期非小细胞肺癌(NSCLC)成人患者的治疗。

图源NMPA官网
此次获批是基于戈来雷塞关键性II期单臂研究的积极结果,戈来雷塞治疗既往经治的KRAS G12C突变晚期NSCLC患者的客观缓解率(ORR)高达49.6%,其中30.8%的患者缓解深度>50%;
疾病控制率(DCR)达86.3%中位无进展生存期(PFS)达8.2个月,中位总生存期(OS)达17.5个月。
值得一提的是,在国内已经上市的KRAS G12C抑制剂中,戈来雷塞仅需每天服用一次即可对肿瘤强力抑制,具有良好的安全性,为患者提供了更耐受的治疗选择。
Olomorasib获FDA授予孤儿药资格,联合K药一线治疗KRAS G12C肺癌ORR达70%
近日,美国食品药品管理局(FDA)已授予礼来(LLY.US)旗下候选药物Olomorasib用于治疗KRAS G12C突变型非小细胞肺癌(NSCLC)的孤儿药资格。
据悉,该药物目前正处于用于上述适应症的三期临床试验阶段。其正在接受评估,作为一线治疗方案,用于KRAS G12C突变型晚期非小细胞肺癌患者,与Keytruda(帕博利珠单抗)联合使用,可选择是否同时联合化疗。
在2025年ASCO大会上,研究数据进一步更新,在40例可评估疗效的患者中,中位随访达9个月,ORR为70%(28/40),疾病控制率(DCR)达90%,多数患者仍在治疗中,缓解持续时间中位数尚未达到,6个月无进展生存率为80%。
结果显示,Olomorasib联合K药作为KRAS G12C突变晚期NSCLC患者的一线治疗方案,无论PD-L1表达如何,均能显示治疗获益。
目前有多款针对KRAS G12C的靶向药正在招募中!想要评估病情是否符合上述招募条件可将病理报告、治疗经历及出院小结等提交至医学部进行初步评估!
NTRK靶点:克服耐药开启广谱抗癌新时代
NTRK之所以被称为“钻石”基因,首先是因为它非常罕见,在中国常见的肺癌、乳腺癌、结直肠癌中,只有1%~5%的患者存在这种突变,而一些罕见的癌症,比如婴儿纤维肉瘤和分泌型乳腺癌,存在NTRK融合的频率却高达90%~100%。其次,针对NTRK融合突变上市的药物及在研的药物临床效果显著,接受治疗的患者通常都能快速起效,很多晚期患者在使用NTRK抑制剂后得到了重生,像钻石一样罕见又珍贵。针对这一靶点,新一代抑制剂正致力于解决第一代药物的耐药难题。
国产新一代"不限癌种"靶向药ICP-723势头强劲
ICP-723是我国自主研发的新一代NTRK抑制剂,可以治疗携带NTRK融合基因的晚期或转移性实体瘤,包括乳腺癌、结直肠癌、肺癌、甲状腺癌等,以及对第一代NTRK抑制剂拉罗替尼和恩曲替尼耐药的患者。
2025年4月16日,诺诚健华宣布,中国国家药品监督管理局(NMPA)药品审评中心(CDE)已受理新一代泛TRK抑制剂Zurletrectinib(ICP-723)用于治疗携带NTRK融合基因的晚期实体瘤成人和青少年(12周岁≤年龄<18周岁)患者的新药上市申请(NDA)。据小编获悉,该药能够有效克服第一代TRK抑制剂的获得性耐药。zurletrectinib是 NTRK+ 儿童及青少年患者的更佳治疗选择。在2025年ASCO大会上,公布了Zurletrectinib的最新研究数据。截至2024年11月23日,共入组18例患者,包括8例儿童患者和10例青少年患者。18例患者中,6例未经TRK抑制剂治疗且经中心实验室确诊NTRK融合基因阳性的患者可进行疗效评估,独立评审委员会(IRC)评估的ORR为100%。
所有患者在首次肿瘤评估时均达到部分缓解(PR),并维持至截止日期。青少年患者的中位起效时间为 1.0 个月,儿童患者的中位起效时间为 0.9 个月。
值得注意的是,一例先前使用第一代 TRK 抑制剂治疗后疾病进展的儿童患者在接受 zurletrectinib 治疗后达到完全缓解 (CR)。
在成年患者中,Zurletrectinib同样表现出色:
●截至2024年11月23日,49例可评估患者ORR达83.7%,完全缓解率10.2%;
●中位缓解持续时间(DOR)和中位无进展生存期(PFS)尚未达到;
●12个月DOR率和PFS率分别为92.0%和90.5%。
●基线时有脑转移的3例患者中,有2例患者达到颅内缓解,这与 zurletrectinib 良好的脑渗透性和强大的颅内活性相一致。
(注:目前这项临床试验仍在招募中,做了基因检测的病友可以拿出报告看看,一旦存在NTRK1/2/3融合,可以马上联系医学部申请是否有机会接受新药治疗,看不懂的病友也可以致电医学部解读报告。)
如何尝试NTRK抑制剂及其他抗癌新药>>
除了ICP-723外,目前正在展开的关于NTRK抑制剂的临床研究还有很多,例如VC004、HG030、ICP723、TL118、TL139等药物等。
想要参加的患者可提交病理报告、治疗经历、出院小结等资料至医学部初步评估病情。
Claudin18.2靶点:实体瘤CAR-T取得历史性突破
近年来,Claudin 18.2作为胃癌和胰腺癌领域的热门靶点,单抗、双抗、ADC(抗体偶联药物)和CAR-T疗法(嵌合抗原受体T细胞免疫疗法)轮番上阵,好不精彩。
Claudin18.2(CLDN18.2)是Claudin蛋白质家族的一员,位于细胞膜表面,正常情况下仅低水平表达于胃黏膜分化上皮细胞,但在病理状态下,Claudin18.2在多种肿瘤中有的表达显著上调,包括80%的胃肠道腺瘤、60%的胰腺肿瘤。此外,CLDN 18.2活化还可见于食管癌、卵巢癌和肺腺癌中,因此是具有潜力治疗癌症的热门靶点。
据小编查阅ClinicalTrials及CDE(国家药监局)发现,目前批准临床的Claudin18.2产品就多达几十款,多数药物均是拟用于治疗晚期胃癌、胰腺癌及实体瘤患者。
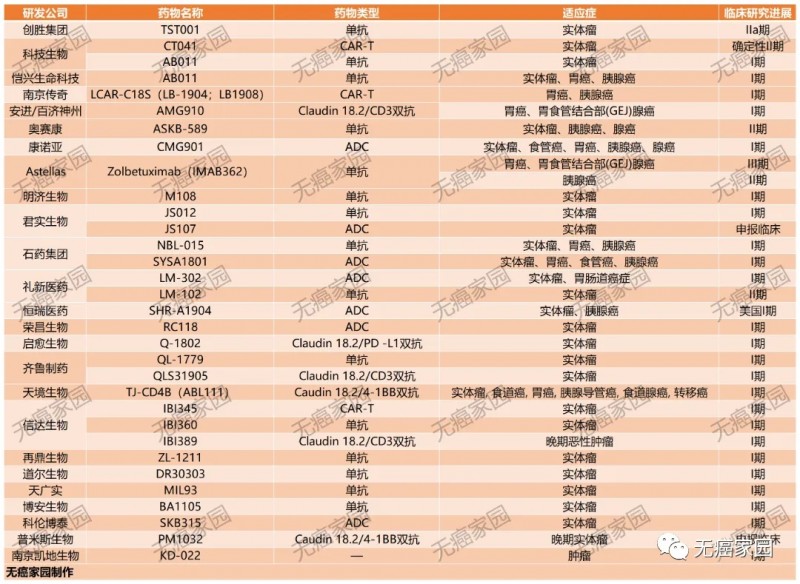
全球首款,实体瘤CAR-T疗法提交上市申请,剑指晚期胃肠道肿瘤
近日,实体瘤CAR-T领域再次传来捷报!2025年6月25日,科济药业宣布,其自体 Claudin18.2 CAR-T 细胞产品舒瑞基奥仑赛注射液(Satri-cel,CT041)的新药上市申请(NDA)已正式提交至中国国家药品监督管理局(NMPA)药品审评中心(CDE),拟用于治疗 Claudin18.2 表达阳性、至少二线治疗失败的晚期胃/食管胃结合部腺癌(G/GEJA)患者。如果一切顺利的话,舒瑞基奥仑赛即将成为全球首款针对实体瘤的CAR-T产品,早日惠及广大胃癌患者。
此次提交的新药上市申请基于在中国 24 个研究中心进行的一项多中心、随机、开放标签、活性对照的 II 期研究。临床试验结果已在国际知名医学期刊《Lancet》和2025年ASCO学会上正式公布。
研究选取2022年3月29日至2024年8月16日,共156例患者随机分配至Satri-cel组(n=104)或TPC组(研究选择治疗组,n=52)。TPC组20例患者随后接受Satri-cel治疗。两组患者既往接受过全身治疗的中位数均为2次,接受≥3线治疗的患者比例分别为26.9%和19.2%;腹膜转移患者比例分别为69.2%和59.6%;Lauren弥漫型/混合型患者比例分别为71.2%和65.4%。无进展生存期(PFS)和总生存期(OS)的中位随访时间分别为8.90个月和12.29个月。
中位总生存期显著延长,死亡风险显著降低
在所有随机人群(ITT)中,基于独立评审委员会(IRC)评价,satri-cel组的 mPFS显示出显著改善(3.25个月 vs 1.77个月,患者疾病进展/死亡风险显著下降达63%,并且 mOS 明显趋于延长(7.92个月 vs 5.49个月)优于 TPC 组。简单来说,相比标准疗法,satri-cel组患者中位总生存期延长了44%。
在实际用药人群(mITT)中,共有136例接受研究药物治疗(satri-cel 88例 +TPC 48例),IRC预测的中位PFS分别为4.37个月 vs 1.84个月,患者疾病进展/死亡风险下降 70%,中位OS分别为8.61个月 vs 5.49个月,死亡风险下降40%。
值得注意的是,接受satri-cel治疗的TPC组患者(n=20)的中位OS为9.20个月。在所有接受satri-cel治疗的患者(n=108)中,与未接受satri-cel治疗的TPC患者(n=28)相比,中位OS分别为9.17个月 vs 3.98个月,患者疾病进展/死亡风险显著下降约72%。
客观缓解率22%,疾病控制率63%
经独立审查委员会(IRC)评估,satri-cel组确诊客观缓解率为 22%(23/104),TPC 组为 4%(2/52);satri-cel组疾病控制率为 63%(65/104),TPC 组为 25%(13/52)。
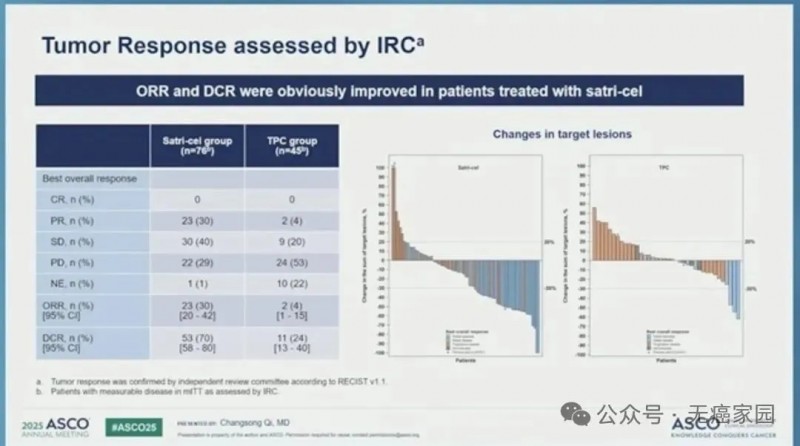
研究结果显示,在 Claudin18.2 表达阳性、至少二线治疗失败的胃/食管胃结合部癌患者中,舒瑞基奥仑赛对比标准治疗可显著改善无进展生存期(PFS),并能够显著延长总生存期(OS),同时安全性可控。
目前急招B细胞淋巴瘤、T细胞淋巴瘤、T细胞白血病(T-ALL)、急性淋巴细胞白血病、非霍奇金淋巴瘤、胃癌、胰腺癌、结直肠癌、间皮瘤、多发性骨髓瘤等癌种!
想要评估病情是否能够接受CAR-T疗法可将病理报告、治疗经历及出院小结等提交至医学部进行初步评估!
小编有话说
对于不同基因突变或不同类型的肺癌,都有不同的规范化的治疗方案。如果早期治疗,可以达到很好的疗效。对于晚期的患者,也同样应该接受规范化的正规治疗,这样不仅可以延长生命,而且还可以达到提高生活质量的目的。
所以确诊为是恶性肿瘤后,一定要带上所有的检查结果,去肿瘤专科医院进行会诊,请肿瘤科专家给出适合自己的治疗方案,这样才不会耽误您的病情。最后祝愿每位患者都能够早日康复,重新拥抱健康!
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐

愈见大"CAR"|C
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

愈见大"CAR"|破
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
晚期肺癌治疗的"双保险&quo
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
全球首款双功能新药中国获批上市!另附20
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

全球肿瘤医生网官宣!GLOBE肿瘤创新药
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

改写乳腺癌宿命!mRNA疫苗+CD27抗
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




