控病率80%+生存率84.6%!FDA批准通用型CAR-T Ⅱ期临床,打破脑瘤、胃癌、肝癌等治疗桎梏
控病率80%+生存率84.6%!FDA批准通用型CART细胞疗法MT027的Ⅱ期临床试验,打破脑瘤、胃癌、肝癌等治疗桎梏
胶质母细胞瘤(GBM)是中枢神经系统最具侵袭性和致命性的癌症之一,常被喻为神经外科的“珠穆朗玛峰”。尽管标准Stupp方案已广泛应用,但患者五年生存率不足5%,复发性患者治疗选择更有限,中位生存期仅6-9个月。因此,迫切需要寻求新的治疗方法。
2025年12月21日,T-MAXIMUM制药公司宣布,其自主研发的同种异体B7-H3靶向CAR-T疗法MT027,已获美国FDA的IND批准,即将启动复发性胶质母细胞瘤(rGBM)II期临床试验。这一里程碑式进展,标志着同种异体CAR-T技术在实体瘤治疗领域实现关键突破!

▲截图源自“PR Newswire”
MT027 CAR-T疗法突破复发性胶质母细胞瘤治疗桎梏,疾病控制率高达80%,1年生存率飙升至84.6%
MT027是一款靶向B7-H3(CD276)基因修饰的同种异体CAR-T细胞,源自健康供体,专为治疗复发性胶质母细胞瘤设计,可精准识别CD276过表达的肿瘤细胞。作为“现成可用”的异体疗法,它能实现大规模生产与冷冻保存,让患者快速接受治疗,有效规避自体细胞生产的延误,这对疾病进展迅速的患者至关重要。与既往依赖慢病毒/逆转录病毒载体的产品不同,T-MAXIMUM制药搭建了完全非病毒的基因编辑平台,既提升了产品安全性,又增强了生产的精确性与可控性,引领细胞治疗工程技术发展方向。
2024年ASCO大会公布了MT027治疗复发性高级别胶质瘤的首次人体试验振奋数据。研究纳入50例B7H3阳性、KPS评分≥40的成人患者(均接受至少1剂治疗,即FAS人群),其中32例接受≥3剂治疗(PPS1人群),15例接受≥3剂且完成至少1次疗效评估(PPS2人群)。
结果显示:PPS1人群中位总生存期(mOS)13.54个月(95%CI:7.45;19.63),12个月总生存率53.30%;PPS2人群mOS达20.73个月(95%CI:16.12;25.34),12个月总生存率84.60%(显著优于14%的历史数据),客观缓解率(ORR)达33%,疾病控制率(DCR)高达80%。

▲截图源自“ASCO”
综上,鞘内或脑室内注射MT027在复发性高级别胶质瘤治疗中,展现出远超历史数据及同类产品的安全性与疗效,显著延长患者总生存期、提升缓解率,为该类难治性肿瘤患者带来全新治疗希望。
GPC3 CAR-T暴击实体瘤,客观缓解率达33.3%
《Nature》首次报道了IL-15共表达对GPC3-CAR-T细胞的人体影响评估,共纳入两个队列患者展开研究:队列1(NCT02905188/NCT02932956)患者接受常规GPC3-CAR-T细胞治疗;队列2(NCT05103631/NCT04377932)患者接受共表达IL-15的GPC3-CAR-T细胞(15.CAR-T)治疗。
结果显示:该疗法显著促进细胞扩增,在3×10⁷个CAR-T细胞/m²(DL2)剂量组中,6例常规GPC3-CAR-T治疗患者均无客观缓解(3例达病情稳定SD);而12例15.CAR-T治疗患者中,4例达SD、4例达到部分缓解(PR)。接受15.CART细胞治疗的患者疾病控制率(DCR)达66%(8/12),客观缓解率(ORR)达33.3%(4/12),其中4号、10号患者肿瘤负荷减少超26%,7号患者残余肿块缩小约12.8%(详见下图B),PET显像显示病灶摄取显著降低,虽未达RECIST缓解标准,但明确体现抗肿瘤活性;另有2例肿瘤分泌AFP的有效患者,其AFP水平均显著下降(相关影像数据详见下图A)。值得关注的是,15.CAR9号患者经MRI检查显示肝脏肿瘤完全坏死,影像引导下病灶取样进一步证实原发性肝脏肿瘤近乎完全坏死。
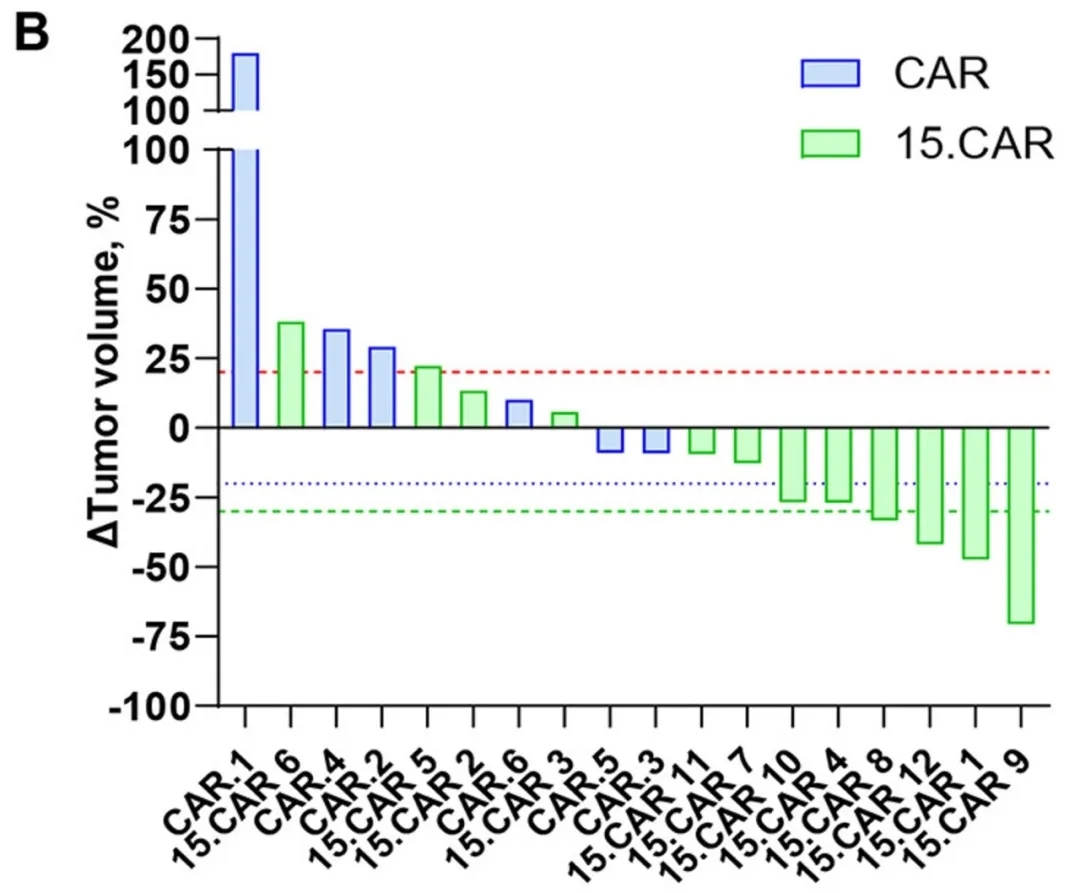
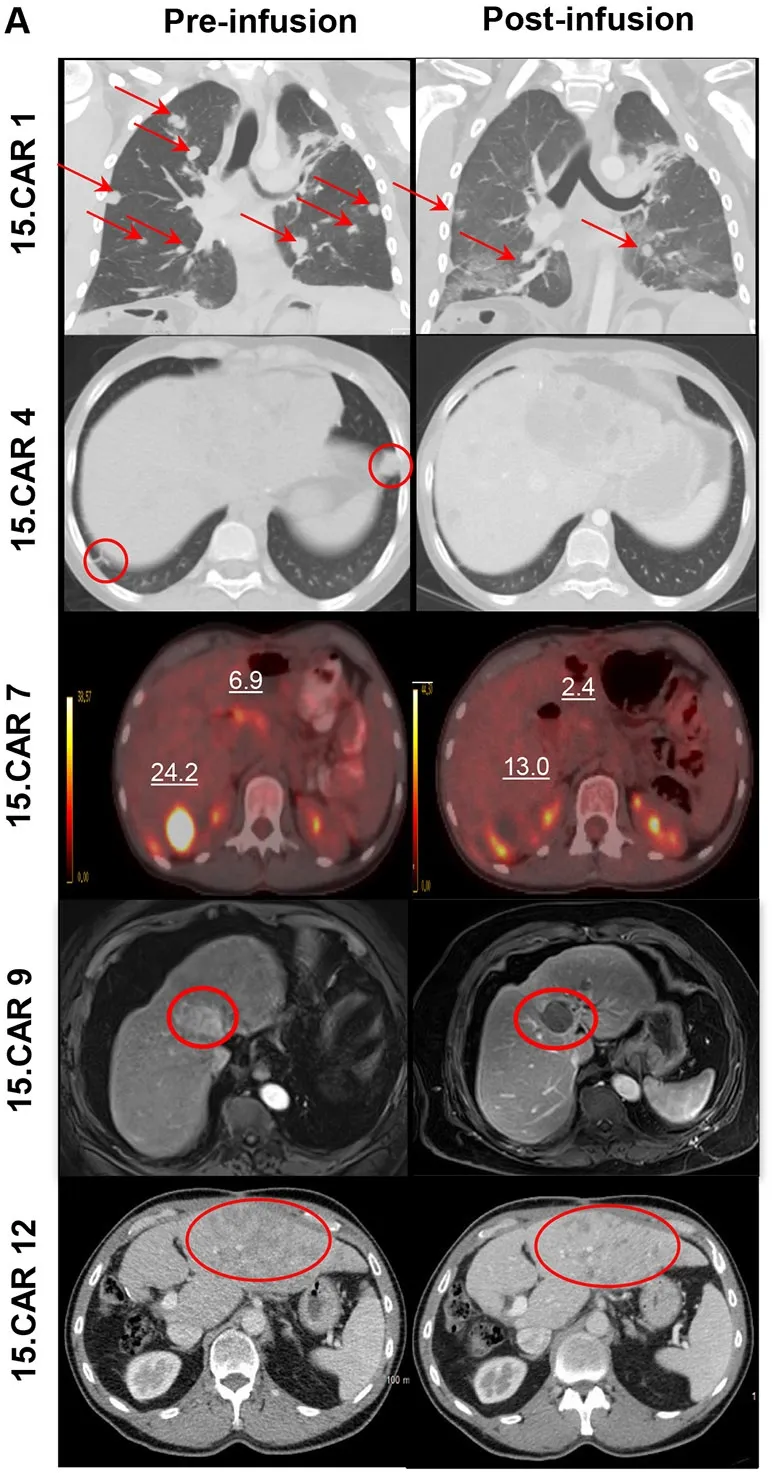
▲图源“Nature”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
中国患者如何寻求CAR-T疗法帮助?
曾经,CAR-T这项先进的治疗技术一直掌握在医疗水平发达的国家,很多病友在苦苦等待中遗憾离开。值得中国病友们振奋的是,“天价”疗法不再遥不可及,中国已成功研发出多款针对多款血液肿瘤及实体瘤的CAR-T疗法,并在国内多家知名癌症中心启动临床,很多晚期患者已通过我们成功入组接受治疗!目前有多款CAR-T临床实验正在火热招募中,主要针对以下靶点及肿瘤类型:
1、血液肿瘤
①CD19:用于淋巴瘤、白血病、B细胞急性淋巴细胞白血病等;
②BCMA:用于多发性骨髓瘤等;
③CD20:用于淋巴瘤、B细胞非霍奇金淋巴瘤、弥漫大B细胞淋巴瘤等;
④CD33:用于急性髓细胞白血病等;
⑤CD3:用于多发性骨髓瘤等;
⑥CD7:用于外周T细胞淋巴瘤等;
⑦CD4:用于淋巴瘤等;
⑧CLL-1:用于急性髓细胞白血病等;
⑨EBV:用于淋巴瘤等。
2、实体瘤
①GPC3:用于肝癌等;
②GUCY2C:用于结直肠癌的治疗;
③PSMA:用于治疗前列腺癌等;
④Claudin18.2:用于胰腺癌、胃癌等;
⑤EGFRvII:用于治疗神经胶质瘤、头颈部肿瘤等;
⑥MUC-1:用于治疗肺癌、胃癌、胰腺癌、肝癌、结肠癌等;
⑦CEA:用于治疗胰腺癌、肺癌、结肠癌、胃癌、乳腺癌等;
⑧间皮素(mesothelin):用于治疗间皮瘤、胰腺癌、卵巢癌、肺癌等;
⑨B7-H3:用于治疗尤文肉瘤、髓母细胞瘤、肾母细胞瘤、神经母细胞瘤、横纹肌肉瘤、特别难以治疗的脑干肿瘤(DIPG)等。
做了基因检测的病友可以拿出报告看看,一旦存在上述突变,可联系医学部,初步评估是否有机会接受国内新药治疗,看不懂的病友也可致电医学部解读报告。
CEA CAR-T腹腔注射疗法打破癌种壁垒,疾病控制率(DCR)高达88%
2024年ASCO大会公布的CEA CAR-T疗法I期临床试验(NCT05396300)首次突破单一癌种限制,纳入35例结直肠癌及胃癌、非小细胞肺癌、胆管癌患者,通过腹腔注射(IP)的创新给药方式实现实体瘤治疗策略革新。
结果显示:腹腔注射组客观缓解率(ORR)为25%,疾病控制率(DCR)达88%。其中高剂量腹腔注射亚组ORR提升至28.5%,且缓解患者的肿瘤持续控制时间均超5个月,其中1例患者在6个月随访时肿瘤病灶缩小76%。相比之下,静脉输注组ORR为8%,DCR为67%。
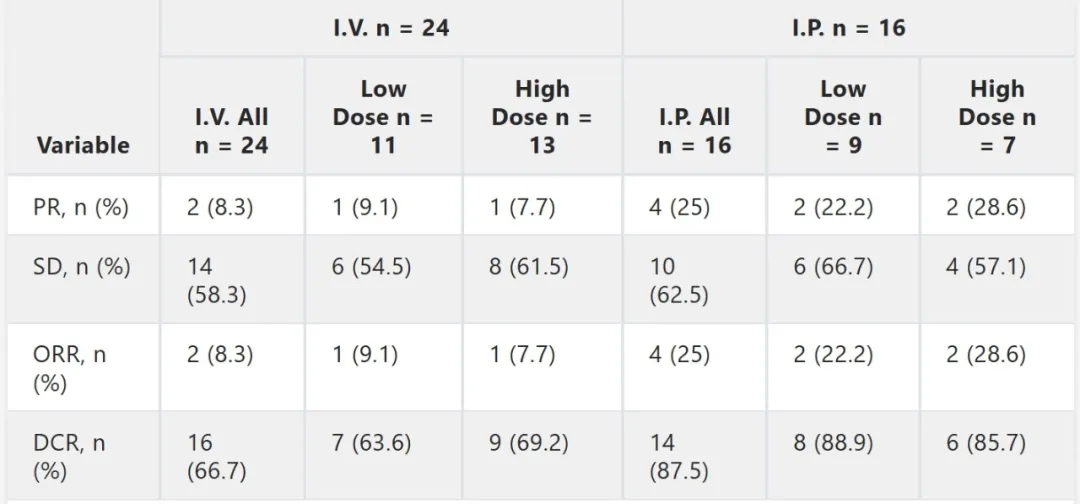
▲数据源自“ASCO”,医学部整理汇总
全球首个!中国CAR-T实体瘤试验登《柳叶刀》,晚期胃癌患者生存期延长40%
CAR-T细胞疗法是一种新型免疫疗法,通过在实验室改造患者自身的T细胞(一种白细胞),使其具备靶向杀伤肿瘤细胞的能力。近日,全球权威期刊《柳叶刀》发表了我国在CAR-T治疗实体瘤领域的里程碑式突破性进展,该成果同步亮相于芝加哥举行的全球最大癌症会议——美国临床肿瘤学会(ASCO)年会。
这是全球首个针对实体瘤的CAR-T细胞疗法2期关键性随机对照试验(NCT04581473),也是CAR-T治疗实体癌的随机试验首次取得积极成果,彰显其在实体癌治疗领域的突破性潜力。该研究共纳入266例晚期胃癌或胃食管连接部(GEJ)癌患者,其中156例随机分至satri-cel组(104例)、标准治疗(TPC)组(52例)。
结果显示:在意向治疗人群中,satri-cel组中位无进展生存期(PFS)达3.25个月(95%CI:2.86-4.53),显著长于TPC组的1.77个月(95%CI:1.61-2.04),风险比0.37(95%CI:0.24-0.56),单侧对数秩检验p<0.0001;同时,接受satri-cel治疗的患者平均生存期较标准治疗组延长约40%。
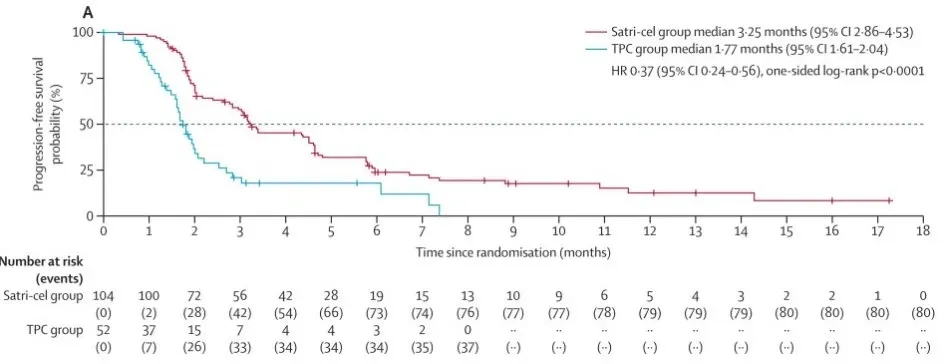
▲图源“The Lancet”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,satri-cel治疗显著改善患者无进展生存期,且安全性可控,为晚期胃癌或胃食管交界处癌患者提供了新型三线治疗方案。
小编寄语
时至今日,CAR-T 细胞疗法在血液系统恶性肿瘤的治疗领域已取得突破性进展,众多患者从中受益。令人欣慰的是,近年来全球的研究人员从未停止探索的脚步,持续钻研各种新型策略,致力于降低肿瘤抗原异质性,打破免疫抑制的困境,为癌症患者带来更多希望!
小编也期望随着越来越多明星靶点的涌现、技术的不断革新,CAR-T疗法可以早日突破价格和癌症治疗的瓶颈,造福更多的癌症晚期患者,实现长期带瘤生存、提高生存质量、降低复发风险的美好愿景!想寻求CAR-T、TCR-T、TIL疗法等国内外抗癌新技术帮助的患者,可将病理检查报告、治疗经历、近期影像学检查等资料汇总后,提交至医学部,进行初步评估,或申请国内外抗癌专家会诊。
参考资料
[1]Shang X,et al.An exploratory investigator-initiated trial via intrathecal or intracerebroventricular delivery of B7H3-specific allogeneic universal CAR-T cells in patients with recurrent high-grade gliomas[J]. 2024.
https://ascopubs.org/doi/10.1200/JCO.2024.42.23_suppl.23
[2]Steffin D,et al.Interleukin-15-armoured GPC3 CAR T cells for patients with solid cancers. Nature. 2025 Jan;637(8047):940-946.
https://pmc.ncbi.nlm.nih.gov/articles/PMC12704925/
[3]Zhang H,et al.Phase I trial of hypoxia-responsive CEA CAR-T cell therapy in patients with heavily pretreated solid tumor via intraperitoneal or intravenous transfusion[J]. 2024.
https://ascopubs.org/doi/10.1200/JCO.2024.42.16_suppl.3514
[4]Qi C,et al.Claudin-18 isoform 2-specific CAR T-cell therapy (satri-cel) versus treatment of physician's choice for previously treated advanced gastric or gastro-oesophageal junction cancer (CT041-ST-01): a randomised, open-label, phase 2 trial[J]. The Lancet, 2025, 405(10494): 2049-2060.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(25)00860-8/abstract
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐

4个月婴儿确诊致命脑瘤被判死刑,革命性抗
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

胰腺癌实现完全缓解!2026癌症疫苗,T
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
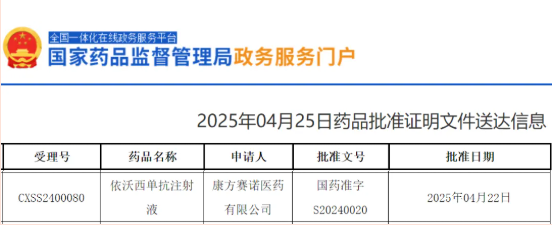
22款肺癌新药扎堆上市!2026这些基因
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
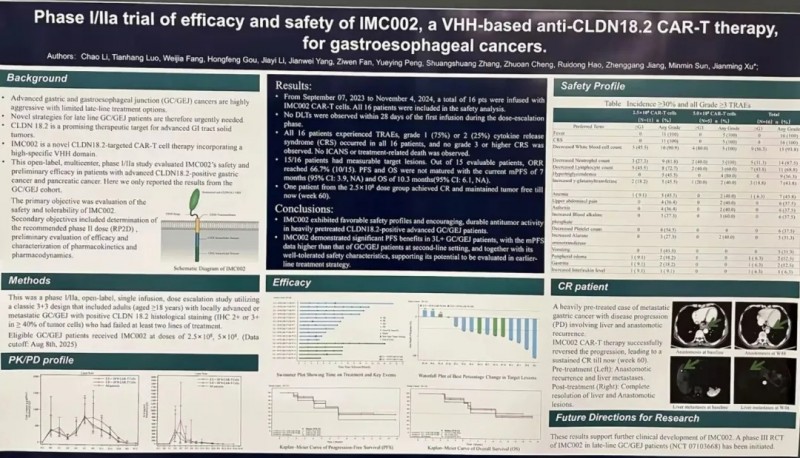
66.7%显著缩小 + 60周持续完全缓
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
"打一针"实现长期生
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

国研双抗突破实体瘤困局!首次人体研究结果
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




