首次人体试验100%控瘤!全球首创HPV-TCR-T引爆2025 ESMO大会!实体瘤新刃斩落肺癌、肝癌、肠癌等
全球首创TCRT细胞疗法引爆2025 ESMO大会,首次人体试验100%控瘤,实体瘤新刃斩落肺癌、肝癌、肠癌等
2025年10月18日,星汉德生物(SCG)官网消息显示,其全球首创HPV特异性TCR-T疗法SCG142,在德国柏林2025年ESMO大会公布首次临床结果。7名复发性或转移性HPV相关癌症患者均出现肿瘤缩小,疾病控制率100%,相关成果将以海报形式在大会展示。
这些结果既凸显SCG142为HPV16、HPV52阳性等癌症患者提供新方案的潜力,也支持进一步评估。目前其全球多中心临床试验正快速推进,这款“中国智造”细胞疗法或改写全球HPV相关癌症治疗选择,为无数饱受病痛折磨的患者带来重生希望,更彰显了中国创新药走向世界、攻克疑难病症的硬核实力,未来可期!

▲图源“SCG”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
全球首个"装甲"TCR-T SCG142震撼登场!以双重创新破解HPV 相关癌症治疗瓶颈,首次人体试验疾病控制率达100%
人乳头瘤病毒(HPV)是最常见的性传播感染,几乎所有性活跃人群均有感染风险,约一半为致癌高危型。目前,HPV感染导致全球超90%的肛门癌和宫颈癌、约70%的阴道癌和外阴癌、6.0%的阴茎癌和口咽癌,每年引发约69万例癌症,占全球恶性肿瘤的5%。仅宫颈癌每年就致35万患者死亡,中晚期复发率达28%-64%。尽管HPV疫苗可降低感染率,但已患癌患者仍缺乏有效疗法,因此迫切需要寻求新的治疗方法。
针对这一现状,SCG142作为一款新型人乳头瘤病毒(HPV)E7特异性T细胞受体工程化T细胞(TCR-T)疗法,具备多重全球领先优势:它是全球首个获批临床、采用TGFβRII-41BB嵌合开关受体「装甲」的下一代TCR-T产品,也是全球首款可同时针对HPV16、HPV52的TCR-T产品,专注治疗HPV相关感染及癌症。
其卓越性能源于两大核心创新:一是通过SCG专有GianTCR™平台筛选高亲和力天然TCR,可同时靶向HPV16/52,覆盖约80%相关患者,且降低脱靶毒性;二是嵌合开关受体「装甲」设计,可使T细胞在肿瘤免疫抑制微环境中激活CD8+与CD4+双细胞亚群,增强抗肿瘤活性。
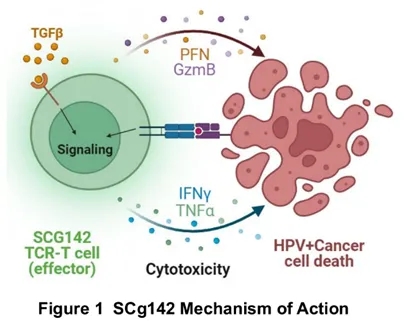
▲图源“SCG”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
临床前研究已证实SCG142可诱导记忆性T细胞长期存续,此次首次人体试验(NCT06544720)首次验证该机制的临床价值。试验旨在评估其安全性、耐受性及初步疗效,入组患者需为HLA-A*02:01阳性、HPV 16/52阳性晚期癌症,且经至少一种系统治疗后病情进展或不耐受。
结果显示:截至数据截止日,7名患者均呈现积极结果。疗效方面,疾病控制率(DCR)达到100%,所有患者均观察到肿瘤缩小或肿瘤负荷减轻;其中57%(4/7)的患者肿瘤缩小超30%,包括2例确认的部分缓解(PR)和2例待确认的PR。此外,安全性显著优于现有细胞治疗产品,不良反应均为1-2级且可逆,无剂量限制性毒性、3级以上不良反应等。
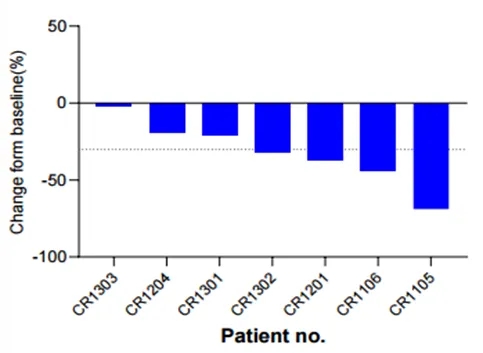
▲图源“SCG”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,SCG142对晚期难治性HPV相关癌症(如宫颈癌)展现出振奋的疾病控制效果,证实了对HPV相关实体瘤的有效性。
全球首个HBV-TCR-T SCG101震撼突破,实现病毒完全清除+肿瘤缩小超74%
除SCG142外,星汉德生物(SCG)还在推进HBV特异性TCR-T细胞疗法SCG101,用于治疗HBV相关肝细胞癌(HCC),该疗法是首个获批临床的HBV特异性TCR-T药物。
2025年5月8日,SCG在荷兰阿姆斯特丹举行的2025年欧洲肝病年会(EASL2025)上,公布了SCG101 I期临床试验(NCT06617000)的最新数据。该研究共入组17例HLA-A*02阳性、经标准治疗失败的晚期HBV相关肝细胞癌患者,均接受自体SCG101细胞单次输注。
结果显示,47%(8/17)患者肿瘤出现可测量退缩;94%患者乙肝表面抗原(HBsAg)水平在28天内断崖式下降1.0~4.6log10,并在最长12个月随访期内持续维持100IU/mL以下。其中23.5%(4例)患者实现HBsAg完全清除且随访期内未复发,中位总生存期截至数据截止尚未达到,远超同类疗法历史数据。
▲截图源自“SCG”
此前在2023年法国巴黎国际细胞与基因治疗大会(ISCT)上,还曾公布过SCG101治疗HBV相关肝细胞癌的突破性案例:一位患者接受单剂治疗后,实现肿瘤缩小与HBV病毒清除的“双向逆转”。
结果显示:治疗第28天,患者肿瘤靶病灶较基线缩小66%,达成部分缓解(PR);第4个月肿瘤进一步缩小至74.5%,一处病灶完全消失,截至数据统计时无进展生存期已超6.9个月,持续维持缓解。
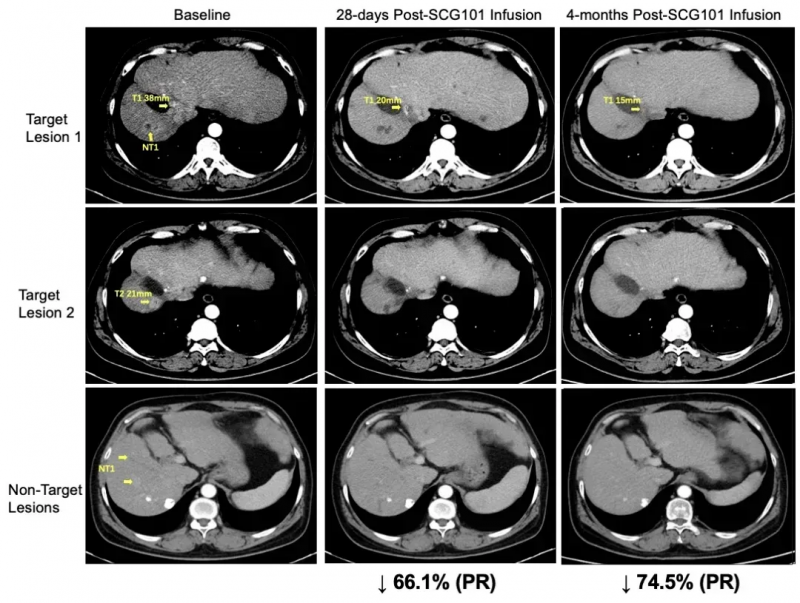
▲图源“SCG”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
此外,肝脏免疫组化显示,回输的SCG101 TCR-T实现100%清除乙肝表面抗原阳性肝细胞;血清学指标显示,HBsAg水平从输注前557.96IU/mL降至第7天1.3IU/mL、第28天0.08IU/mL,近乎清零。
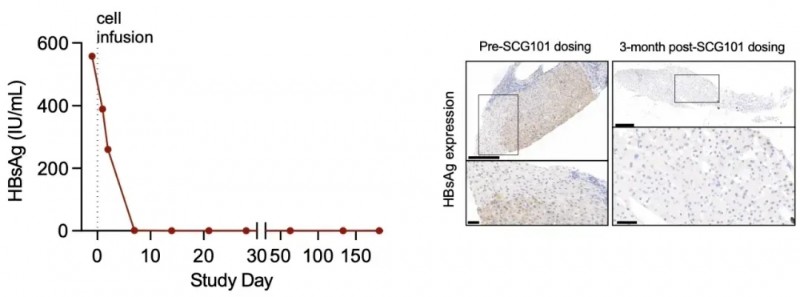
▲图源“SCG”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
NY-ESO-1 TCR-T疗法亮剑非小细胞肺癌,晚期患者实现部分缓解,肿瘤大幅缩小
非小细胞肺癌(NSCLC)占肺癌病例的80%以上,其中晚期(IIIb期和IV期)患者无法手术,需依赖放疗、化疗、靶向治疗及免疫治疗等全身治疗手段。但放化疗副作用显著,更棘手的是,多数患者对免疫检查点阻断疗法无反应,且针对EGFR、KRAS等突变的靶向治疗也常因耐药失败,因此,迫切需要新的治疗方案。
近年研究发现,NY-ESO-1抗原具有成为癌症免疫治疗靶点的潜力。该抗原在11.8%~21%的NSCLC患者中表达,13%~20%的肺癌患者、23%的NSCLC患者血清中可检测到抗NY-ESO-1抗体。基于此,研究人员研发了针对NY-ESO-1的TCR-T细胞疗法,并开展临床研究(NCT02457650)。该研究纳入4例HLA-A2阳性且NY-ESO-1抗原表达的NSCLC患者,采用“淋巴细胞清除化疗+NY-ESO-1TCR-T细胞输注+全身性IL-2”的联合治疗方案。
结果显示:2例分别接受3次、2次细胞输注的患者获得临床反应:按RECIST1.1标准,1例治疗后近3个月维持病情稳定(SD);1例(患者2)治疗后4个月达到部分缓解(PR),且疗效与安全性表现尤为突出。
值得一提的是,其中一例晚期肺腺癌女性(患者2),在接受治疗后不仅达到部分缓解(PR),且无明显毒性,生活质量与临床症状显著改善:卡氏功能状态评分(KPS)从50分提升至90分,咯血、胸痛症状明显减轻,胸腔积液完全吸收、肺组织复张。同时,其血清中细胞因子IFN-γ水平在细胞输注后第二周达峰值(首次输注后48.92pg/ml,二次输注后47.63pg/ml),随后逐渐回落。更直观的是肿瘤缩小数据:治疗第43天的CT显示,肺部原发灶从95×86×54mm缩小至64×44×54mm,肝部转移灶从19.8×19.6×20mm缩减至10×10×10mm。
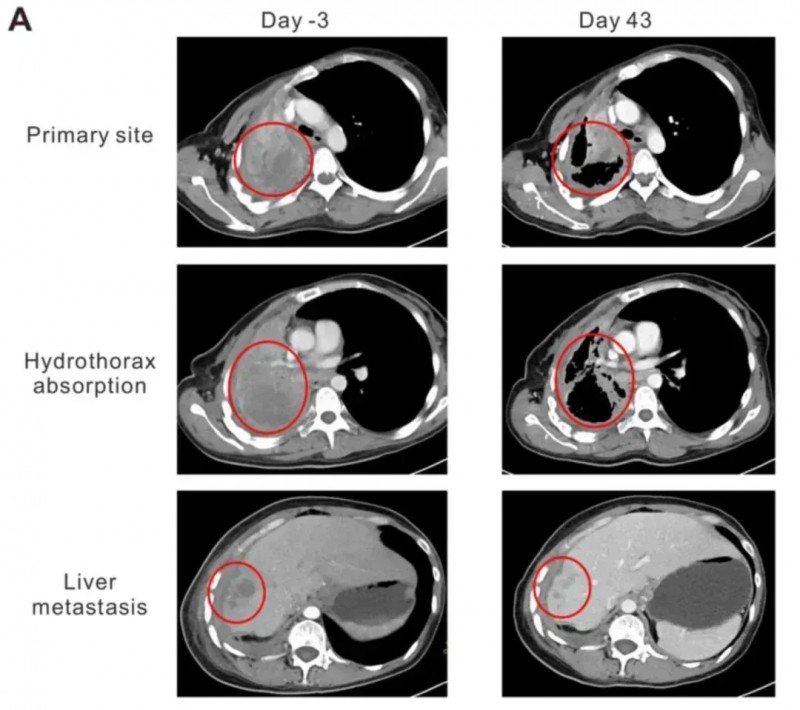
▲图源“OncologyLetters”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,这些数据充分印证了NY-ESO-1 TCR-T疗法的强大抗肿瘤活性,不仅能显著改善患者临床症状,更展现出逆转晚期NSCLC病情的巨大潜力。
前期治疗失败也有救!TCR-T疗法让结直肠癌转移灶"缩水",缓解最长达7个月
一项转移性结直肠癌TCR-T治疗Ⅱ期中期临床试验,共纳入7例错配修复功能正常的转移性结直肠癌患者。这些患者在多种前期治疗失败、病情进展后,抱着最后希望入组,接受了实验性个性化TCR-T细胞免疫疗法联合派姆单抗与IL-2治疗。该疗法的制备过程为:从患者肿瘤浸润淋巴细胞中分离新抗原反应性T细胞受体(TCR),将其α和β链整合到γ逆转录病毒载体中。
结果显示:按RECIST标准评估,3例患者出现客观临床反应,肝脏、肺及淋巴结的转移性肿瘤均消退,缓解持续4~7个月。
下图为一例典型患者接受TCR-T治疗前后左肺转移灶的CT图像对比:治疗前,患者左肺存在转移性肿瘤;治疗后,转移灶明显消退(详见下图)。
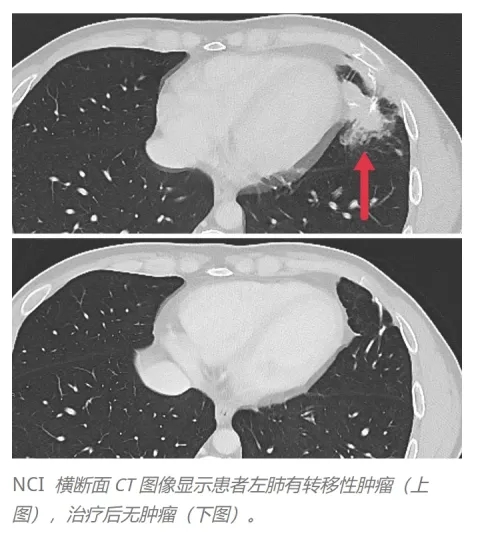
▲图源“nature”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
TCR-T疗法:实体瘤新利器
“TCR-T”即“T细胞受体工程化T细胞疗法(T-cell receptor engineered T cell therapy,TCR-T)”,是通过基因工程技术,将TCR基因序列导入T细胞的疗法。这一过程相当于给T细胞安装“精密感知器”,使其能特异性识别肿瘤抗原,精准揪出并杀死狡猾的肿瘤细胞。
相比CAR-T疗法,TCR-T拥有更广泛的靶点,目前已在多项临床试验中(尤其在实体瘤治疗领域)取得亮眼成绩(详见下表)。
▼目前已经进入临床试验阶段的代表性靶点及TCR-T疗法
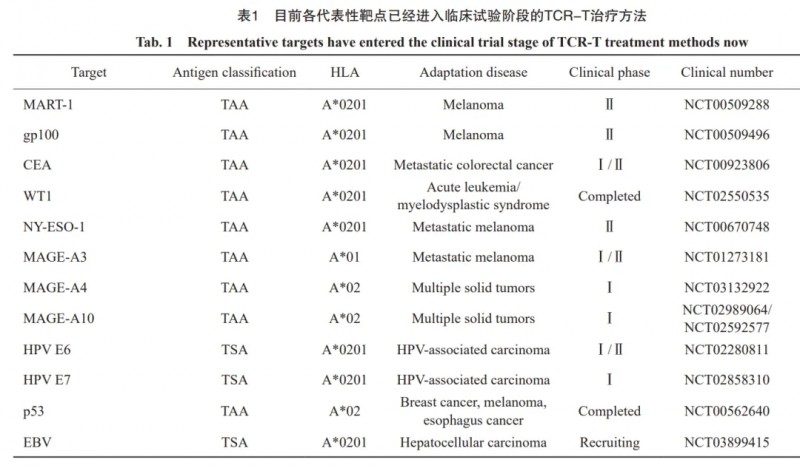
▲数据源自“China Oncology”
做过基因检测的病友可以拿出报告看看,一旦存在上述癌症种类或突变,可联系医学部,进行初步评估,看不懂报告检测的病友,也可以致电医学部详细阅读。
小编寄语
TCR-T疗法作为一种新型抗肿瘤方案,虽与CAR-T同属于T细胞疗法,但其具有归巢能力强、靶点范围更广的优点,如果说CAR-T疗法是治疗血液肿瘤的利器,那么TCR-T疗法就是治疗实体瘤的新型武器,其在治疗肝癌、非小细胞肺癌、胰腺癌、黑色素瘤、宫颈癌、滑膜肉瘤等多种实体瘤方面具有独特的优势。我们也期望未来会有越来越多的靶点和TCR-T细胞产品问世,让更多的实体瘤患者获益!
好消息是,目前国内多家癌症中心启动TCR-T疗法的临床试验,主要针对乙型肝炎病毒相关肝细胞癌、妇科恶性肿瘤(卵巢癌、子宫内膜癌)、晚期葡萄膜黑色素瘤、鼻咽癌、血液系统恶性肿瘤等多癌种,进行临床招募。如果您想寻求TCR-T细胞疗法或国内外其他治疗新技术的帮助,可咨询医学部,详细评估病情!
参考资料
[1]Xia Y,et al.Treatment of metastatic nonsmall cell lung cancer with NYESO1 specific TCR engineeredT cells in a phase I clinical trial: A case report[J]. Oncology letters, 2018, 16(6): 6998-7007.
https://www.spandidos-publications.com/10.3892/ol.2018.9534
[2]Parkhurst,et al.Adoptive transfer of personalized neoantigen-reactive TCR-transduced T cells in metastatic colorectal cancer: phase 2 trial interim results. Nat Med (2024).
https://www.nature.com/articles/s41591-024-03109-0
[3]Weitao Z,et al.TCR-T immunotherapy for the treatment of solid tumor: current status, challenges and future prospects[J]. China Oncology, 2023, 33(7): 707-716.
http://www.china-oncology.com/EN/abstract/abstract1917.shtml
[4]https://www.scgcell.com/newsinfo/10770542.html
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐

4个月婴儿确诊致命脑瘤被判死刑,革命性抗
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

胰腺癌实现完全缓解!2026癌症疫苗,T
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
22款肺癌新药扎堆上市!2026这些基因
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
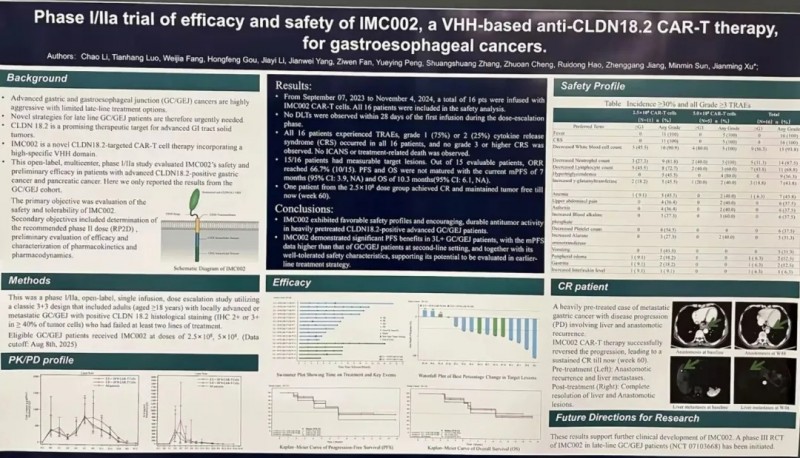
66.7%显著缩小 + 60周持续完全缓
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
"打一针"实现长期生
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

国研双抗突破实体瘤困局!首次人体研究结果
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




