刚刚!新型CAR-T布瑞基奥仑赛中国申报上市!100%无残留+超3年生存期,开启强效抗癌模式
2025年9月24日CAR-T细胞疗法布瑞基奥仑赛(Brexucabtagene autoleucel)向国家药监局申报上市
2025年9月24日,中国国家药品监督管理局药品审评中心(NMPA)官网显示,复星医药旗下复星凯瑞的布瑞基奥仑赛注射液已申报上市,拟用于治疗复发/难治性前体B细胞急性淋巴细胞白血病成人患者。
这一申报上市的进展,意味着中国该类白血病患者有望更快触达国际前沿的治疗方案,为无数期盼新生的家庭点亮希望!
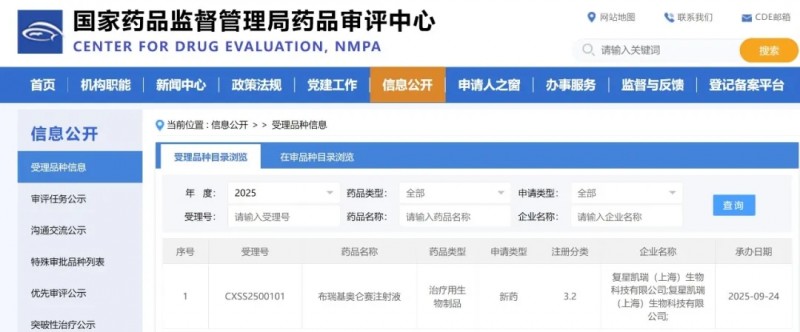
▲截图源自“NMPA”
布瑞基奥仑赛:FDA与中国临床都认可的白血病新药,为患者带来"长生存+无残留"新希望
布瑞基奥仑赛(Brexucabtagene autoleucel,简称Brexu-cel,商品名Tecartus、KTE-X19)是一款自体抗CD19 CAR-T细胞疗法,复星凯瑞拥有其在中国内地、香港及澳门地区的权益。该药此前已在美国、欧盟、加拿大等多个国家和地区获批上市,适应症涵盖套细胞淋巴瘤与B细胞急性淋巴细胞白血病(B-ALL)。
FDA批准实至名归!布瑞基奥仑赛凭超3年长生存数据+63%CR率,登顶权威期刊
布瑞基奥仑赛(Brexu-cel,KTE-X19)此前已获美国食品药品监督管理局(FDA)批准,用于治疗复发或难治性B前体急性淋巴细胞白血病(R/R B-ALL)成人患者。该批准主要基于ZUMA-3临床研究(NCT02614066)的振奋数据,相关结果已同步发表于全球权威期刊《Nature》子刊《Leukemia》。
该研究共纳入78例年龄≥18岁的复发或难治性B前体急性淋巴细胞白血病(R/R B-ALL)患者,中位随访时间达41.6个月(范围:32.7–70.3个月;N=78)。
结果显示:经研究者评估,78名患者的总体完全缓解(CR)/不完全血液学恢复的完全缓解(CRi)率达74%,其中完全缓解(CR)率为63%。在微小残留病(MRD)层面,所有接受治疗患者的最佳总体MRD阴性率为79%(95%CI:69-88,n=78),而治疗应答者中这一比例更是高达98%(95%CI:91-100,n=58)。
生存期数据同样亮眼:全部78名患者的中位总生存期(OS)为25.6个月(95%CI:16.2-47.0),58名治疗应答患者的中位OS则达到38.9个月(≈3.2年,95%CI:25.4-无法估计)(详见下图)。这意味着经过约3.5年的中位随访,患者能从Brexu-cel疗法中持续获益——58名治疗应答患者的中位总生存期超3年!更为惊喜的是,数据截止时,有9名患者未接受后续治疗及异基因造血干细胞移植,仍保持持续缓解状态。
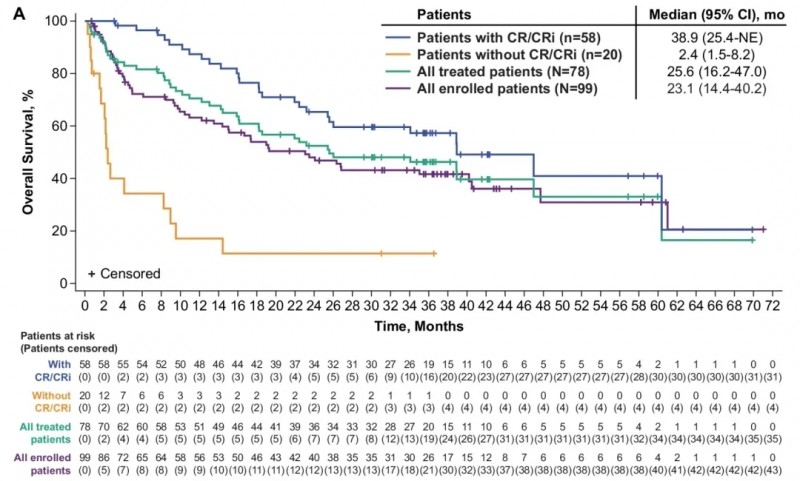
▲图源“Leukemia”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
布瑞基奥仑赛中国Ⅱ期数据震撼发布,100%MRD阴性+78.6%缓解率
除上述数据外,复星凯瑞还于今年6月公布了布瑞基奥仑赛(Brexu-cel,KTE-X19)在中国复发或难治性B前体急性淋巴细胞白血病(R/RB-ALL)患者中的II期桥接注册临床研究(ChiCTR2300073872)最新结果,旨在评估KTE-X19治疗中国R/RB-ALL人群的疗效与安全性。
该研究共纳入32例R/RB-ALL患者,中位年龄35.5岁(范围:19-66岁);其中28例患者在淋巴细胞清除后接受单次布瑞基奥仑赛(Brexu-cel,KTE-X19)输注,中位随访时间为8.1个月(90%CI:5.9,9.1)。
结果显示:总体完全缓解(CR)/不完全血液学恢复的完全缓解(CRi)率达78.6%(90%CI:62.0%,90.2%)(详见下图);中位无复发生存期(RFS)与中位缓解持续时间(DOR)暂无法估计;所有应答者的微小残留病(MRD)均为阴性(100%)。
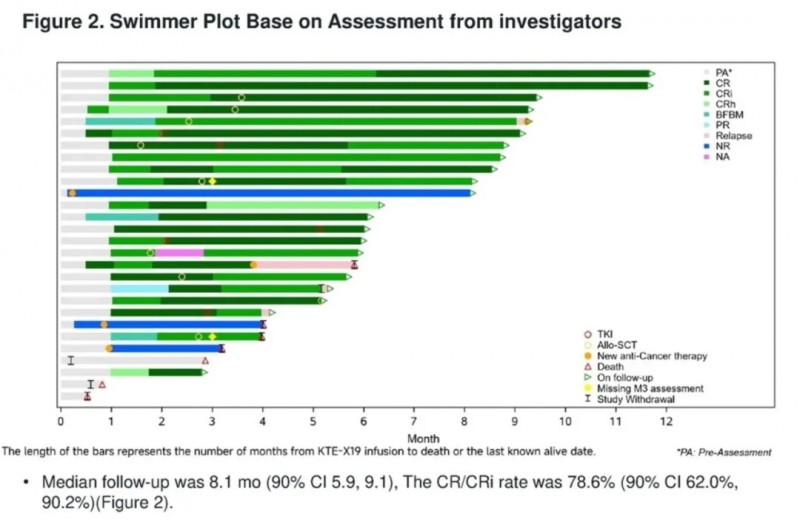
综上,布瑞基奥仑赛在中国R/RB-ALL成年患者中展现出较高的CR/CRi率与100%的MRD阴性应答率,同时安全性可控。
全面盘点中国已获批上市的CAR-T疗法
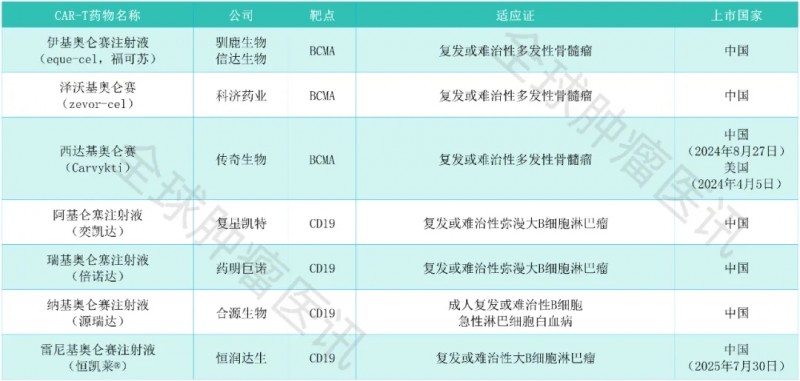
01、伊基奥仑赛注射液(eque-cel、福可苏)
药品简介
①药物名称:伊基奥仑赛注射液(福可苏®,Equecabtagene Autoleucel Injection)。
②研发公司:驯鹿生物和信达生物。
③治疗靶点:BCMA。
④适应证:复发/难治性多发性骨髓瘤。
⑤获批时间:2023年6月30日。
药物详情
伊基奥仑赛注射液是一款全人源B细胞成熟抗原特异性CAR-T细胞,同时中国首款获批的BCMA CAR-T疗法,以及全球首款全人源BCMA靶向的CAR-T疗法!
2023年6月30日,获国家药品监督管理局(NMPA)批准上市,用于治疗复发/难治性多发性骨髓瘤(R/R MM)。1/2期临床研究数据显示,总体缓解率(ORR)竟高达96.0%!
02、泽沃基奥仑赛(zevor-cel)
药品简介
①药物名称:泽沃基奥仑赛(zevor-cel,Zevorcabtagene Autoleucel,赛恺泽®,产品编号CT053)。
②研发公司:科济药业。
③治疗靶点:BCMA。
④适应证:复发或难治性多发性骨髓瘤。
⑤获批时间:2024年3月1日。
药物详情
泽沃基奥仑赛是一款靶向BCMA的自体CAR-T细胞产品,同时也是中国第五款CAR-T。2024年3月1日,新药上市申请获中国国家药品监督管理局(NMPA)批准,用于成年患者复发或难治性多发性骨髓瘤的治疗,这些患者既往接受过包括1种免疫调节剂、蛋白酶体抑制剂在内的至少3线治疗。
本次获批主要是基于一项中国LUMMICAR STUDY 1 Ⅰ/Ⅱ期临床试验(NCT03975907)的振奋数据。结果显示:所有患者的中位PFS长达25.0个月(14.9,不可评估[NE])。其中21.4%(3例)的患者达到部分缓解(PR);78.6%(11例)的患者达到完全缓解(CR)或严格完全缓解(sCR)。
03、西达基奥仑赛(Carvykti)
药品简介
①药物名称:西达基奥仑赛(cilta-cel,Carvykti)。
②研发公司:传奇生物。
③治疗靶点:BCMA。
④适应证:复发或难治性多发性骨髓瘤(R/R MM)。
⑤获批时间:2024年4月5日。
药物详情
西达基奥仑赛(cilta-cel,Carvykti)是传奇生物与强生创新制药联合研发的靶向BCMA的CAR-T细胞疗法,于2024年4月5日获美国FDA批准,用于治疗对来那度胺(Revlimid)耐药、且既往接受过包括蛋白酶体抑制剂(PI)、免疫调节剂(IMiD)在内至少一线治疗的成年复发或难治性多发性骨髓瘤(R/RMM)患者。
此次获批基于3期CARTITUDE-4临床研究(NCT04181827)的振奋数据。结果显示,西达基奥仑赛组总体缓解率达84.6%,显著高于标准治疗组的67.3%;完全缓解(CR)率差距更为显著,西达基奥仑赛组达73.1%,标准治疗组仅21.8%。12个月无进展生存(PFS)率方面,西达基奥仑赛组为75.9%,标准治疗组为48.6%。治疗期间,西达基奥仑赛组60.6%的患者微小残留病(MRD)呈阴性,标准治疗组这一比例为15.6%。
04、阿基仑塞注射液(奕凯达)
药品简介
①药物名称:阿基仑赛注射液(Axicabtagene Ciloleucel Injection,axi-cel,FKC876,奕凯达®)。
②研发公司:复星凯特。
③治疗靶点:CD19。
④适应证:复发或难治性大B细胞淋巴瘤。
⑤获批时间:2021年6月1日。
药物详情
阿基仑赛注射液是一款CD19 CAR-T产品,同时也是中国首个以药品途径批准上市的CAR-T细胞治疗产品。2021年6月22日在中国获批上市,用于治疗成人复发或难治性大B细胞淋巴瘤(r/r LBCL)。
ZUMA-12的2期临床研究(NCT03761056),数据显示:ORR率达82%,12个月时预计OS率达91%(95% CI,73–97),12个月时的PFS率为75%(95% CI,55–87)。
05、瑞基奥仑塞注射液(倍诺达)
药品简介
①药物名称:瑞基奥仑赛注射液(relma-cel,relmacabtagene autoleucel,倍诺达®,Carteyva®)
②研发公司:药明巨诺。
③治疗靶点:CD19。
④适应证:大B细胞淋巴瘤、套细胞淋巴瘤、滤泡性淋巴瘤。
⑤获批时间:2021年9月1日、2025年6月4日。
药物详情
瑞基奥仑赛注射液是中国首个获批用于治疗复发或难治性套细胞淋巴瘤(r/r MCL)的靶向CD19的CAR-T细胞治疗产品,同时也是国内首个拥有三项适应症的CAR-T疗法。
2021年9月1日在中国获批上市,用于治疗既往经过二线或以上系统性治疗后,复发或难治性大B细胞淋巴瘤。RELIANCE研究(NCT04089215)的4年随访结果显示:结果显示:3年总生存(OS)率为69.3%,4年总生存(OS)率为66.7%。
2025年6月4日,其新药上市许可申请(NDA)获中国澳门药物监督管理局批准,新增适应症包括:经二线或以上系统性治疗的成人复发或难治性大B细胞淋巴瘤(r/r LBCL);经二线或以上系统性治疗的成人难治性或24个月内复发的滤泡性淋巴瘤(r/r FL);经包括布鲁顿酪氨酸激酶抑制剂(BTKi)在内的二线及以上系统性治疗的成人复发或难治性套细胞淋巴瘤(r/r MCL)。
06、纳基奥仑赛注射液(源瑞达)
药品简介
①药物名称:纳基奥仑赛注射液(源瑞达®,CNCT19细胞注射液,Inaticabtagene Autoleucel Injection)。
②研发公司:合源生物。
③治疗靶点:CD19。
④适应证:B细胞急性淋巴细胞白血病。
⑤获批时间:2023年11月8日。
药物详情
纳基奥仑赛注射液是一款靶向CD19的CAR-T细胞治疗产品,同时也是中国首款治疗白血病的CAR-T细胞产品。
2023年11月8日在中国获批,用于治疗成人复发或难治性B细胞急性淋巴细胞白血病(r/r B-ALL),治疗3个月总体缓解率(ORR)高达82.1%!
07、雷尼基奥仑赛注射液(恒凯莱)
药品简介
①药物名称:雷尼基奥仑赛注射液(HR001,商品名:恒凯莱®)。
②研发公司:恒润达生。
③治疗靶点:CD19。
④适应证:复发/难治性大B细胞淋巴瘤。
⑤获批时间:2025年7月30日。
药物详情
雷尼基奥仑赛注射液(HR001,商品名:恒凯莱®)是恒润达生研发的靶向CD19CAR-T细胞疗法,于2025年7月30日获国家药品监督管理局(NMPA)批准上市,它也成为了我国第4款获批的CD19CAR-T细胞疗法。其适应症为成人经二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤(非霍奇金淋巴瘤中最常见的亚型),具体包括弥漫性大B细胞淋巴瘤非特指型、滤泡性淋巴瘤转化的弥漫性大B细胞淋巴瘤、伴MYC和BCL2重排的高级别B细胞淋巴瘤、高级别B细胞淋巴瘤非特指型。
2024年美国癌症研究协会(AACR)大会上,公布了该药治疗复发/难治性非霍奇金淋巴瘤(R/RNHL)的2期临床试验(HRAIN01-NHL01-II)主要数据。
结果显示:中位缓解持续时间(DOR)为339天(95%CI:149-NE),中位最佳缓解时间为30天(范围:28-358天);中位无进展生存期(PFS)为176天(95%CI:91-NE),总生存期(OS)尚未达到。客观缓解率(ORR)方面,3个月、6个月及最佳ORR分别为53.1%、45.7%、74.1%;完全缓解率(CRR)方面,3个月、6个月及最佳CRR分别为32.1%、29.6%、49.4%。
百万疗法免费招募!中国成功研发多款CAR-T疗法,国内多家中心启动招募
曾经,CAR-T这项先进的治疗技术一直掌握在医疗水平发达的国家,很多病友在苦苦等待中遗憾离开。值得中国病友们振奋的是,“天价”疗法不再遥不可及,中国已成功研发出多款针对多款血液肿瘤及实体瘤的CAR-T疗法,并在国内多家知名癌症中心启动临床,很多晚期患者已通过医学部成功入组接受治疗!目前有多款CAR-T临床实验正在火热招募中,主要针对以下靶点及肿瘤类型:
在研癌种及靶点
目前有多款CAR-T临床实验正在火热招募中,主要针对以下靶点及肿瘤类型:
1)CEA:用于治疗肺癌、胰腺癌、胃癌、乳腺癌、结肠癌等;
2)Claudin18.2:用于治疗胰腺癌、胃癌等;
3)GPC3:用于肝癌等治疗;
4)GUCY2C:用于结直肠癌的治疗;
5)PSMA:用于治疗前列腺癌等;
6)GPEGFRvII:用于治疗神经胶质瘤、头颈部肿瘤等;
7)间皮素(mesothelin):用于治疗间皮瘤、胰腺癌、肺癌、卵巢癌等;
8)MUC-1:用于治疗胃癌、肝癌、肺癌、胰腺癌、结肠癌等;
9)B7-H3:用于治疗髓母细胞瘤、肾母细胞瘤、尤文肉瘤、神经母细胞瘤、横纹肌肉瘤、特别难以治疗的脑干肿瘤(DIPG)等。
10)BCMA:用于多发性骨髓瘤等治疗;
11)CD19:用于治疗白血病、淋巴瘤、B细胞急性淋巴细胞白血病等;
12)CD20:用于治疗淋巴瘤、弥漫大B细胞淋巴瘤、B细胞非霍奇金淋巴瘤等。
部分入组条件
1)自愿参加本研究并能够签署知情同意书;
2)筛选时年龄18〜70岁;
3)至少有1处可测量靶病灶(根据RECISTvl.l定义);
4)入选和治疗前世界卫生组织(WHO)/ECOG体能状态(PS)评 分为0或1分;
5)经超声心动图左室射血分数(LVEF)>45%;
6)肺部无活动性感染。
申请流程
做过基因检测的患者,可自行查看基因检测报告,一旦发现存在上述突变,可将近期病理报告、基因检测报告等资料汇总后,提交至医学部,初步评估是否有机会参加相关临床试验。一旦审核通过,有机会获得”天价“疗法免费治疗的机会。看不懂检测报告或想要明确相关靶点的患者,也可联系医学部,详细解读报告或了解检测详情。
我们的专家将为您全面分析解读检测报告,预计一个工作日内电话联系推荐用药方案,并匹配适合患者入组的临床试验项目。注:作为国内权威的肿瘤患者服务平台,我们承诺对所有受试者的个人信息保密,并保证在整个过程中,遵循国家临床研究相关的法律法规。
小编寄语
CAR-T细胞疗法作为免疫细胞疗法中的“佼佼者”,其在血液肿瘤中的治疗效果有目共睹,中美等国更是有多款产品相继获批上市。值得欣慰的是,近年来研究人员开始将研发重点集中在CAR-T治疗实体瘤方面,并取得了不俗的成绩。近年来,CAR-T研发更是进入了“百家争鸣”的局面,助癌症患者从黑暗走向光明!
目前我国有多款CAR-T细胞疗法的临床试验相继开展,并有幸运患者获得完全缓解!感兴趣的病友可将影像学检查、近期病理报告、基因检测报告、治疗经历等资料,提交至医学部,详细评估病情或申请国内外抗癌专家会诊!
参考资料
[[1]Shah B D,et al.Three-year analysis of adult patients with relapsed or refractory B-cell acute lymphoblastic leukemia treated with brexucabtagene autoleucel in ZUMA-3[J]. Leukemia, 2025: 1-11.
https://www.nature.com/articles/s41375-025-02532-7
[2]https://library.ehaweb.org/eha/2025/eha2025-congress/4159810/meng.lv.kte-x19.in.relapsed.or.refractory.adult.b-cell.acute.lymphoblastic.html?f=menu%3D6%2Abrowseby%3D8%2Asortby%3D2%2Amedia%3D3%2Ace_id%3D2882%2Aot_id%3D31558%2Amarker%3D5844%2Afeatured%3D19595
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐

4个月婴儿确诊致命脑瘤被判死刑,革命性抗
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

胰腺癌实现完全缓解!2026癌症疫苗,T
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
22款肺癌新药扎堆上市!2026这些基因
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
66.7%显著缩小 + 60周持续完全缓
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
"打一针"实现长期生
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

国研双抗突破实体瘤困局!首次人体研究结果
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05









![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




