2025年末六款国研抗癌新药扣响上市大门!肺癌/胃癌/乳腺癌/胰腺癌等首闯3期临床
2025年末六款国研癌症新药扣响上市大门!肺癌/胃癌/乳腺癌/胰腺癌等首闯3期临床
III期临床试验是抗癌新药上市前的“终极考验”,作为药物研发进程中至关重要的里程碑,这一“治疗作用确证阶段”更是药物获得监管批准的最后一道关键关卡。令人振奋的是,2025年10-11月共有6款抗癌新药首次迈入III期临床阶段,涵盖ADC、小分子靶向药、双特异性抗体等多种创新类型,聚焦KRAS、CLDN18.2、DLL3等热门靶点,治疗范围覆盖乳腺癌、肺癌、胰腺癌、宫颈癌等多种实体瘤,正式向上市申请发起冲刺。
我们第一时间梳理汇总了“2025年10~11月首次进入III期临床阶段的国研抗癌新药榜单”,以供癌友们参考(注:下列信息仅供参考,具体用药方案需遵循医嘱,也可联系医学部,进行初步评估)。
2025年10~11月六款国研抗癌新药首次冲刺Ⅲ期临床
IBI363:鳞状非小细胞肺癌
IBI363是信达生物自主研发的一款全球首创PD-1/IL-2α偏向性双特异性抗体融合蛋白,通过阻断PD-1/PD-L1通路、顺式激活α偏向性IL-2通路,精准激活共表达PD-1和IL-2α的肿瘤特异性T细胞(尤其耗竭T细胞),为免疫治疗耐药及冷肿瘤患者提供新方向。
临床进展方面,该药斩获多项重要认定:2024年9月获FDA快速通道资格,用于一线治疗后进展的不可切除晚期/转移性黑色素瘤;针对免疫疗法耐药的鳞状非小细胞肺癌(NSCLC),同时获FDA快速通道资格与中国NMPA突破性疗法认定(BTD)。
2025年8月24日,该药全球III期临床试验(MarsLight-11)获FDA批准(首个全球III期研究),计划在中美等多国招募约600名患者,对比IBI363与多西他赛,治疗铂类化疗联合抗PD-(L)1治疗后进展的不可切除/局部晚期/转移性鳞状NSCLC。

▲截图源自“BioSpace”
此前在2025年ASCO大会上,就曾公布了该药I期首次人体试验(NCT05460767)的振奋数据。该研究共纳入136例经标准治疗失败的晚期NSCLC患者(中位年龄61岁,72%的患者既往接受过≥2线治疗),接受IBI363静脉注射。结果显示该药耐受性良好,且在不同亚型、不同剂量组中均展现出令人鼓舞的持久疗效:
1、鳞状细胞癌患者(至少1次基线后肿瘤评估):3mg/kg组疗效显著优于1/1.5mg/kg组,客观缓解率(ORR)分别为43.3% vs 25.9%,疾病控制率(DCR)分别为90.0% vs 66.7%,中位无进展生存期(PFS)为7.3个月(95%CI:6.0-11.7) vs 5.5个月(95%CI:1.5-8.3)(两组中位随访时间分别为7.3个月、11.1个月)。
2、PD-(L)1治疗失败且无可操作基因组改变的腺癌患者:3mg/kg组同样表现更优,ORR分别为28.0%(3mg/kg组)vs 16.7%(0.6/1/1.5mg/kg组),DCR为76.0% vs 63.3%,中位PFS分别为4.2个月(95%CI:3.0-无法估计) vs 2.8个月(95%CI:1.4-5.1)(两组中位随访时间分别为5.9个月、16.5个月)。
3、特殊人群获益显著:吸烟者(占比56.4%)的ORR(29% vs 4%)和PFS(5.3个月 vs 2.7个月)均高于非吸烟者。

▲截图源自“ASCO”
ZL-1310:小细胞肺癌
ZL-1310(通用名zocilurtatugpelitecan,简称zoci)是再鼎医药基于TMALIN®ADC平台开发的靶向DLL3创新抗体偶联药物,也是全球进度最快的DLL3 ADC。其由人源化抗DLL3单克隆抗体通过可裂解连接体,与新型喜树碱衍生物(拓扑异构酶I抑制剂)偶联而成,该平台可借助肿瘤微环境特性优化药物输送,在提升疗效的同时突破早期ADC的诸多局限性。
2025年10月24日,再鼎医药公布ZL-1310全球I期临床试验(NCT06179069)最新数据:该研究共纳入115名铂类化疗后进展的广泛期小细胞肺癌(ES-SCLC)患者,其中90%经免疫检查点抑制剂治疗失败。
结果显示,该药展现出强劲持久的抗肿瘤活性及良好安全性,有望成为SCLC治疗的一流DLL3靶向ADC:各剂量水平均维持高缓解率,二线治疗亚组(n=53)中1.6mg/kg组最佳总体缓解率(ORR)达68%;32例脑转移患者反应显著,未接受脑放疗者ORR高达80%;7例tarlatamab经治患者中3例实现缓解(该类患者入组仍在进行);全人群中位缓解持续时间(DoR)6.1个月、中位无进展生存期(PFS)5.4个月,在多线治疗失败的难治性患者中疗效具有明确临床意义。
临床推进方面,该药的全球III期临床试验ZL-1310-003已启动,计划招募约665名患者,对比ZL-1310与研究者选择的单药治疗(ICT),用于铂类一线治疗后进展的复发性SCLC(含一线化疗后接受tarlatamab治疗的患者)的二线及以上治疗。此外,ZL-1310针对一线SCLC及神经内分泌癌的相关项目正在推进,预计2026年进入注册阶段。

▲截图源自“zaiLab”
JS107:胃/胃食管结合部腺癌
JS107是一款以单甲基澳瑞他汀E为有效载荷的CLDN18.2特异性抗体偶联药物(ADC)。2025年11月26日,其III期临床试验(CTR20254590)正式启动,旨在评估JS107对比研究者选择治疗,用于CLDN18.2阳性晚期胃/胃食管结合部腺癌二线及以上治疗的疗效与安全性。
此前,2025年AACR大会公布了JS107首次人体I期临床试验(NCT05502393)的安全性与有效性数据,该研究包含单药(A部分,63例)和联合治疗(B部分,27例)队列(截至2025年1月7日)。

▲截图源自“AACR”
结果显示:CLDN18.2高表达(≥20%肿瘤细胞染色强度≥2+)的胃/胃食管结合部癌患者中:A部分单药(2.0-3.0mg/kg,n=24)客观缓解率(ORR)34.8%(8/23,95%CI:16.4-57.3,详见下图),中位无进展生存期(PFS)4.11个月;B部分联合治疗(n=14)ORR高达78.6%(11/14,95%CI:49.2-95.3),且两部分均明确显示CLDN18.2表达水平与疗效正相关。
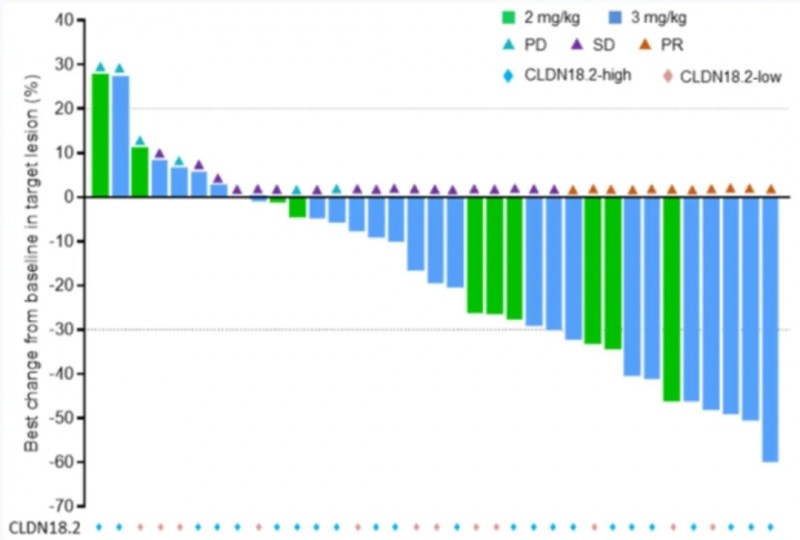
▲图源“AACR”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,JS107单药或联合托瑞普利单抗+XELOX方案治疗该类高表达患者,疗效良好且安全性可控,首次证实CLDN18.2靶向ADC联合治疗的临床获益。
HRS-4642:胰腺癌
HRS-4642是恒瑞医药研发的首个进入III期临床的KRAS G12D靶向药,为KRAS G12D突变肿瘤治疗提供了全新精准方案。
2025年10月24日,恒瑞医药在国内启动一项随机、对照、双盲、多中心III期临床研究,旨在评估HRS-4642联合吉西他滨+白蛋白结合型紫杉醇(AG方案),对比安慰剂联合AG方案一线治疗携带KRAS G12D基因突变的晚期或转移性胰腺癌的有效性和安全性。
▲截图源自“NIH”
此前,2025年ESMO大会以口头报告形式公布了该药Ib/II期研究(NCT06520488)的振奋数据:研究共纳入31例KRAS G12D突变型胰腺导管腺癌(PDAC)患者,其中30例为初治患者、1例为经治患者,中位随访4.4个月时仍有83.9%(26例)患者在接受治疗。
结果显示:经治患者病情稳定(SD)超7个月且持续治疗中。而30例初治患者的确认客观缓解率(ORR)达60.0%(95%CI:40.6%-77.3%),疾病控制率(DCR)高达93.3%(95%CI:77.9%-99.2%,详见下图);18例缓解者中17例仍维持缓解,中位缓解持续时间尚未成熟。
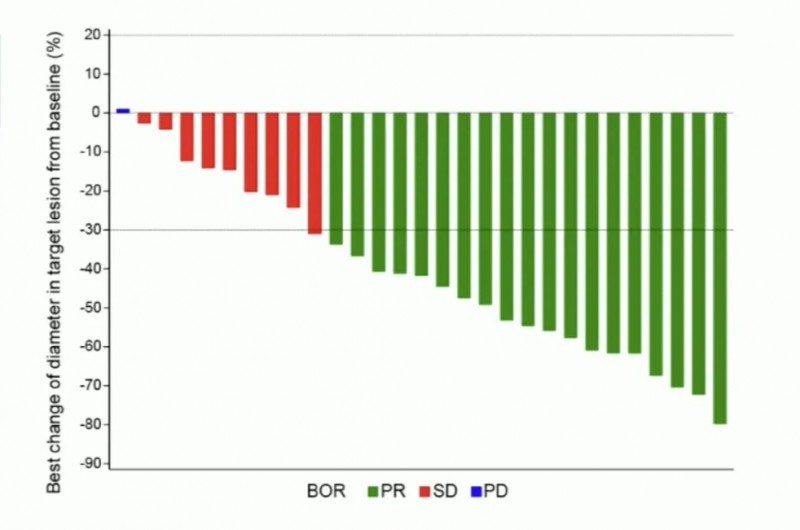
▲图源“ESMO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
总之,上述研究证实,HRS-4642联合AG方案在晚期KRAS G12D突变型胰腺导管腺癌中展现出令人鼓舞的抗肿瘤活性和可控的安全性,目前长期疗效与安全性数据仍在持续随访中。
JS105:乳腺癌
JS105是润佳医药研发的一款选择性突变型PI3Kα抑制剂,而PIK3CA基因激活突变在多种癌症中高发,且与内分泌治疗、靶向治疗及化疗耐药密切相关,为这类患者提供了精准治疗方向。
2025年10月3日,JS105的III期临床研究(NCT07207070)在国内启动,旨在评估JS105联合达尔西利+氟维司群,对比达尔西利+氟维司群单药治疗PIK3CA突变、HR阳性、HER2阴性复发或转移性乳腺癌患者的疗效与安全性。
此前在2025年ESMO大会上,就曾公布了JS105单药治疗(NCT06846099)与联合治疗(NCT06208410)在晚期癌症患者中的初步疗效和安全性的振奋数据。截至2025年3月28日,单药治疗研究共纳入69例患者,其中32例PIK3CA突变患者的客观缓解率(ORR)达28.1%,疾病控制率(DCR)为87.5%;联合治疗研究纳入31例患者,安全性方面未发现新的风险信号,其中23例PIK3CA突变患者的ORR为39.1%,DCR达87.0%。

▲截图源自“ESMO”
SYS6002:宫颈癌
SYS6002(又称CRB-701)是石药集团巨石生物研制的一款注射用重组人源化抗Nectin-4单克隆抗体-MMAE偶联药物,作为新一代靶向Nectin-4的ADC,其核心优势在于位点特异性可裂解连接子、均一稳定的2:1药物-抗体比例(DAR=2)及MMAE有效载荷,精准靶向Nectin-4阳性肿瘤细胞。
该药已获重要监管认可:2024年12月5日,美国FDA授予其治疗复发/难治性(R/R)转移性宫颈癌的快速通道资格,凸显其临床潜力。2025年11月17日,石药集团启动III期临床试验(NCT07230626),旨在评估SYS6002对比研究者选择的化疗方案,治疗经铂类化疗联合抗PD-(L)1药物治疗失败的复发/转移性宫颈癌患者的疗效与安全性。
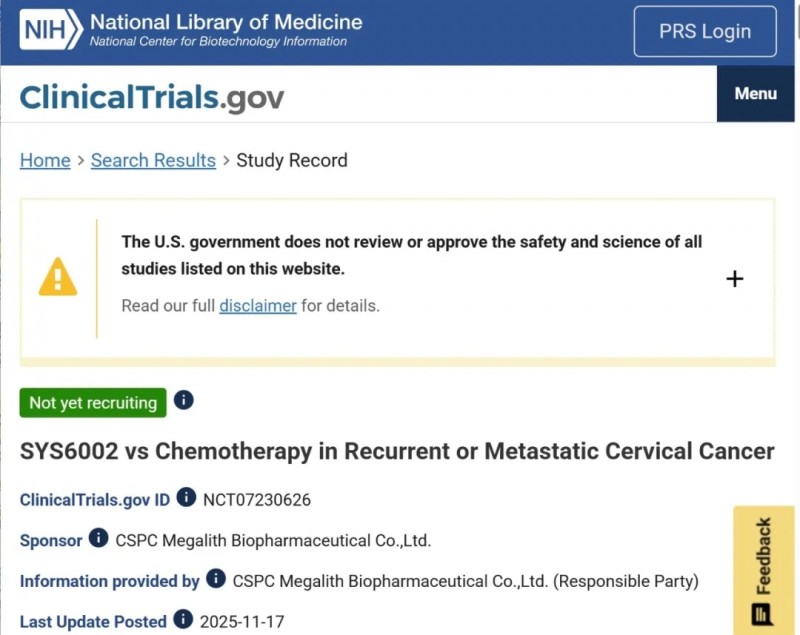
▲截图源自“NIH”
早期临床数据已展现积极信号:2024年ASCO大会公布的首次人体试验结果显示:该药在既往接受过中位4线治疗的Nectin-4阳性实体瘤患者中,耐受性良好且抗肿瘤活性显著。其中,剂量≥2.7mg/kg组(n=6)未确认客观缓解率(ORR)达50%,宫颈癌患者ORR更是高达67%(2/3),尿路上皮癌患者ORR为50%(1/2);在Nectin-4中高表达(H评分≥150)的4例患者中,3例达到部分缓解,ORR达75%,充分印证了其在高表达人群中的治疗优势。
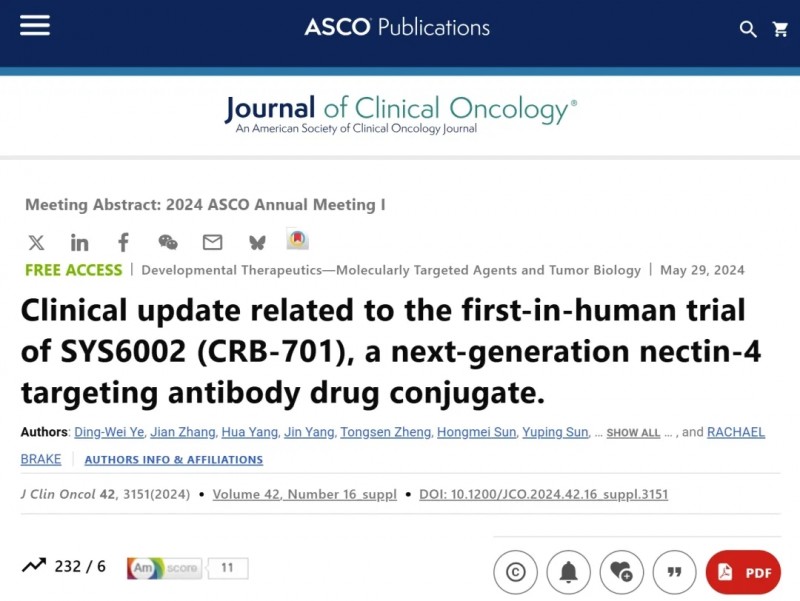
▲截图源自“ASCO”
小编寄语
上文所提及的新药/新技术,不过是众多研发热潮中的冰山一角,实际上还有众多在研的抗癌新药/新技术正在如火如荼地进行中,为广大癌症患者带来了新的希望和更有效的治疗选择。我们也期待这些新药能够顺利通过评审,尽快应用于临床实践,让更多的癌症患者有药可医!
好消息是,当前有多款在研药物已经陆续开启临床试验阶段,这也意味着中国患者将有获得最新抗癌药物免费治疗的机会。与此同时,“方舟援助计划”也可为患者提供已上市/未上市抗癌新药免费治疗的机会。对现有治疗方案不满意或耐药的患者,可将治疗经历、近期病理及影像学检查报告等资料,提交至医学部,进行初步评估或了解详细的入排标准。
参考资料
[1]Xu R H,et al. Abstract CT010: Phase I dose-escalation and expansion study of JS107, a claudin 18.2 (CLDN18. 2)-targeting antibody-drug conjugate (ADC), as monotherapy or in combination for patients (pts) with advanced solid tumors[J]. Cancer Research, 2025, 85(8_Supplement_2): CT010-CT010.
https://aacrjournals.org/cancerres/article/85/8_Supplement_2/CT010/761491/Abstract-CT010-Phase-I-dose-escalation-and
[2]Wang L,et al. 2215O HRS-4642 combined with gemcitabine and nab-paclitaxel in KRAS-G12D mutant advanced pancreatic cancer: A phase Ib/II study[J]. Annals of Oncology, 2025, 36: S1231.
https://www.annalsofoncology.org/article/S0923-7534(25)03752-4/fulltext
[3]Yan M,et al.466P Efficacy and safety of JS105, a selective inhibitor of mutant PI3Kα, in patients with advanced cancer[J]. Annals of Oncology, 2025, 36: S394.
https://www.annalsofoncology.org/article/S0923-7534(25)01810-1/fulltext
[4]Ye D W,et al.Clinical update related to the first-in-human trial of SYS6002 (CRB-701), a next-generation nectin-4 targeting antibody drug conjugate[J]. 2024.
https://ascopubs.org/doi/10.1200/JCO.2024.42.16_suppl.3151
[5]https://ir.zailaboratory.com/news-releases/news-release-details/zai-lab-announces-updated-phase-1-data-zocilurtatug-pelitecan
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐

愈见大"CAR"|C
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

愈见大"CAR"|破
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
晚期肺癌治疗的"双保险&quo
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
全球首款双功能新药中国获批上市!另附20
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

全球肿瘤医生网官宣!GLOBE肿瘤创新药
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

改写乳腺癌宿命!mRNA疫苗+CD27抗
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




