里程碑!首医大附属胸科医院完成国研TIL首个肺癌给药!100% DCR,横扫肠癌等多癌种
里程碑!首医大附属胸科医院完成国研TIL细胞疗法首个肺癌给药!100%DCR,横扫多个癌种
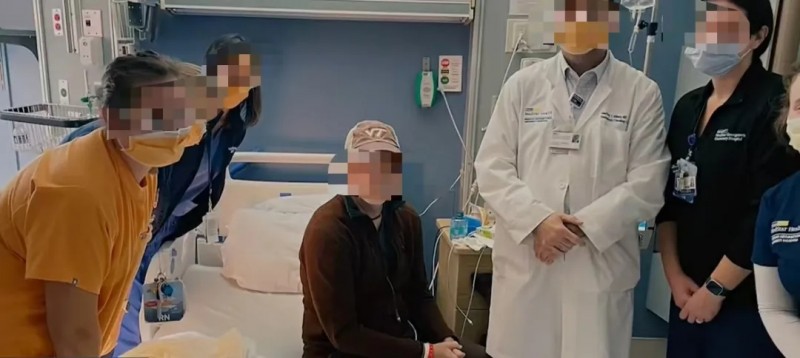
据“华赛伯曼”官微消息,近日,首都医科大学附属北京胸科医院肿瘤中心成功完成“我国自主研发的TIL细胞注射液——HS-IT101(即FAST-TIL),治疗晚期非小细胞肺癌(NSCLC)临床研究的首个患者给药”。据悉,该患者已顺利完成细胞输注及全程安全监控,经专业评估后已顺利出院。
此次临床研究的推进,不仅为我国乃至全球TIL细胞治疗的产业化发展注入强劲动力,更标志着我国肿瘤细胞治疗领域正式跻身全球前沿!从自主研发突破到临床落地见效,中国TIL疗法正以硬核实力打破治疗壁垒、续写抗癌奇迹,为无数非小细胞肺癌等实体瘤患者带来了全新的希望与选择!
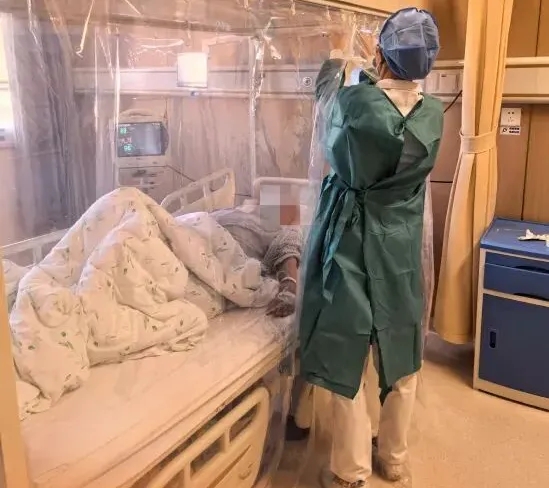
▲图源“华赛伯曼官微”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
国研FAST-TIL(HS-IT101):凭100% DCR跻身全球TIL疗法第一梯队,黑色素瘤Ⅱ期临床扬帆起航
FAST-TIL(HS-IT101)作为我国自主研发的创新改良型TIL产品,采用全封闭自动化培养体系,仅需≥0.05g肿瘤组织即可制备,生产周期缩短至14天(行业常规周期22—28天),大幅提升治疗可及性的同时,进一步扩大了适用人群。更值得关注的是,2025年11月17日,该疗法获国家药监局药审中心(CDE)批准开展晚期黑色素瘤关键II期临床试验,成为国研TIL疗法领域的重大里程碑!
其实早在2025年欧洲肿瘤内科学会(ESMO)年会上,首次公布了“FAST-TIL(HS-IT101)联合低剂量IL-2,治疗晚期实体瘤的I期临床试验(NCT06342336)”黑色素瘤亚组的突破性数据。
结果显示:截至2025年10月,10例完成治疗及至少一次肿瘤评估的受试者中,4例确认疾病缓解,包括1例达到完全缓解(CR)、3例达到部分缓解(PR)。初始客观缓解率(ORR)达40%,疾病控制率(DCR)更是高达100%;中位随访超5个月,中位无进展生存期(mPFS)仍未达到,疗效显著优于美国已上市同类产品AMTAGVI(ORR 31.4%、mPFS 4.2个月)!
▼黑色素瘤受试者FAST-TIL(HS-IT101)治疗后靶病灶总和(SOD)变化
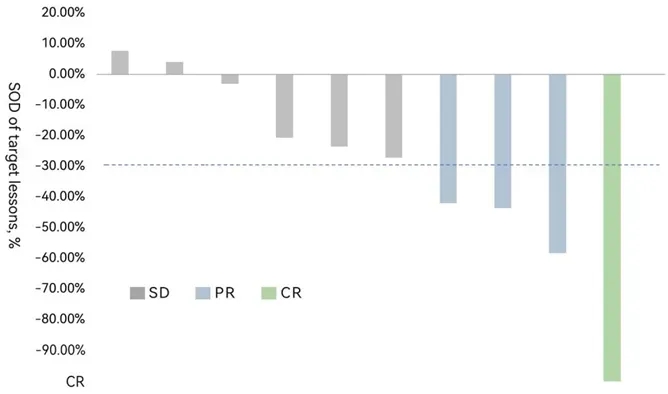
▲图源“华赛伯曼官微”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,从技术创新突破到临床数据亮眼,国研FAST-TIL正以硬核实力改写肿瘤治疗格局,为实体瘤患者带来更可及、更高效的治疗新选择!
TIL细胞:深藏肿瘤组织的"抗癌精锐",开启"以癌治癌"新时代
我们的免疫系统本就会动员免疫细胞进入肿瘤组织,与癌细胞正面交锋并尝试消灭它们。而肿瘤浸润淋巴细胞疗法(TILs),正是一种“借力打力”的过继性免疫细胞疗法——从癌症患者自身的肿瘤组织中,采集那些已“渗透”到肿瘤里的淋巴细胞,在体外进行大量扩增和培养后,再回输到患者体内,让这些“本土抗癌部队”精准识别并清除癌细胞。
储存TILs细胞有何用武之地
1、术后辅助治疗(针对肿瘤早期患者):帮助清除手术残留的癌细胞,降低肿瘤复发风险;
2、末线补救治疗(针对晚期肿瘤患者):为“无药可用”的晚期患者带来新选择,有望延长生存时间、提升生活质量。
TIL疗法的主要治疗步骤
1、切除肿瘤组织:医生先切除患者病变部位的肿瘤组织,这些组织中既包含癌细胞(浅蓝色),也混杂着已浸润的T淋巴细胞(绿色、红色、深蓝色);随后会初步评估,判断这些组织是否能制备出足够数量的T细胞。
2、分离扩增TIL细胞:将肿瘤标本送到专业的GMP实验室,分离出其中的淋巴细胞后,加入高浓度的白细胞介素-2(IL-2)进行培养,通常3周左右,就能将TIL细胞扩增到数十亿个。
3、筛选“抗癌精锐”细胞群:让扩增后的T淋巴细胞与患者自身的癌细胞进行反应测试,只保留那些能有效触发杀瘤效应的“阳性TIL群”(红色),其余无效细胞(深蓝色、绿色)则予以丢弃。
4、术前准备-淋巴细胞清除术:患者在接受TIL回输前,需要先进行淋巴细胞清除治疗,为回输的TIL细胞“腾出空间”,让它们能更好地在体内定植、发挥作用。
5、TIL回输回输并激活:通过静脉输注等方式,将制备好的TIL细胞回输到患者体内;之后会配合IL-2治疗,为TIL细胞提供“生长支持”,帮助它们快速激活、增殖,精准找到并消灭潜伏的癌细胞(详见下图)。
▼TIL疗法治疗过程示例图
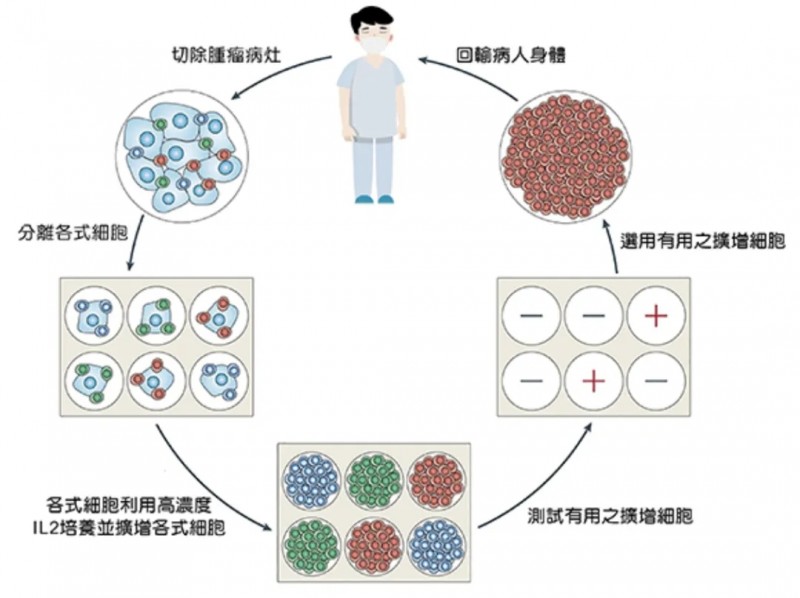
▲图源“TBCF”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
冷肿瘤也有"临床治愈"希望!国研TIL疗法突破脑癌"禁区",复发性胶质母细胞瘤患者持续完全缓解近2年
胶质母细胞瘤(GB)是最具侵袭性的原发性脑癌亚型,复发迅速且治疗手段有限。尽管目前已有多种治疗方案,但复发性GB患者的中位总生存期仅6-10个月,因此迫切需要寻求新的治疗方法。
此前,CAR-T细胞疗法已在脑瘤治疗领域取得突破性进展,《新英格兰医学杂志(NEJM)》就曾报道过CARv3-TEAM-ET细胞治疗脑胶质瘤后肿瘤快速消退的案例。
而近年,肿瘤浸润淋巴细胞(TIL)疗法在胶质母细胞瘤(GB)治疗中的潜力也逐步显现——《癌症免疫治疗杂志》最新报道了我国开展的1期临床试验(NCT04943913),旨在评估TIL疗法对复发性胶质母细胞瘤患者的安全性与有效性。其中一例患者奇迹般获得完全缓解。其振奋人心的数据,为复发性GB患者带来了全新希望。
该幸运患者是一位56岁男性,确诊为左侧额叶胶质母细胞瘤(IDH野生型,WHO4级,EGFR扩增):2023年1月接受肿瘤切除术后,经Stupp方案治疗病情短暂稳定后复发;后续虽接受了针对IL-13Rα2和B7-H3两种抗原的17次CAR-T治疗,病情仍持续进展。最终患者入组TIL临床试验,研究团队先从其初始手术切除标本中,成功制备TIL细胞;再经预处理后,为患者进行了TIL细胞输注。
结果显示:输注前患者复发病灶最大直径达2.8cm,而输注后4周(2024年1月8日),肿瘤被完全切除;截至2025年9月9日,患者已维持完全缓解状态超过1.8年,持续获益显著(详见下图)。
▼该患者治疗过程中的磁共振成像(MRI)图像。
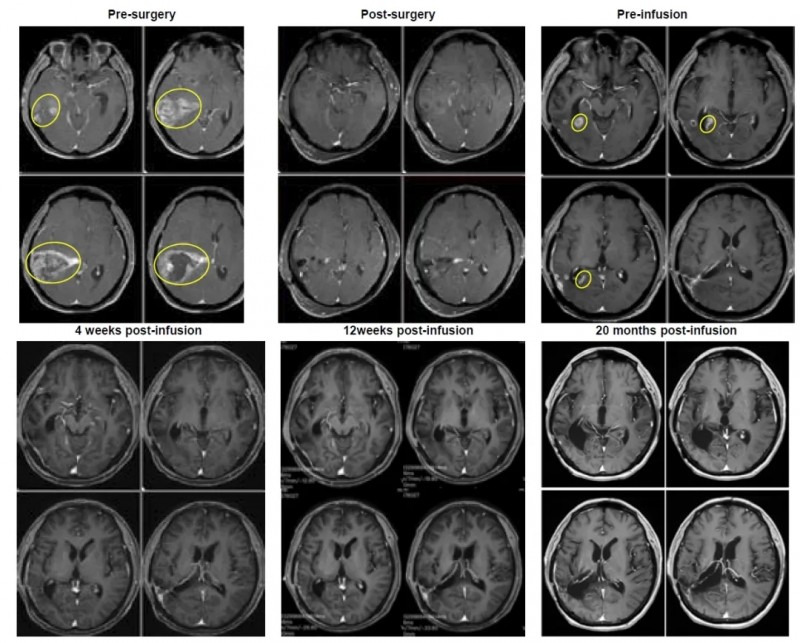
▲图源“BMJ”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,该研究证实,即便胶质母细胞瘤被归类为“冷肿瘤”,其肿瘤浸润淋巴细胞仍可在体外有效扩增;而颅内病灶的完全缓解,更直接证明了TIL细胞具备穿过血脑屏障的关键能力——这一突破解决了脑瘤治疗的核心难题之一。从CAR-T到TIL疗法,免疫治疗正持续突破脑癌治疗的“禁区”,为晚期脑瘤患者带来了新的希望和选择!更重要的是,从患者早期手术切除组织中提取的TIL细胞,成功实现了复发性肿瘤的缓解,这凸显了早期留存肿瘤组织标本,对复发性GB患者后续接受TIL治疗的重要临床价值。
全球首款!国研GC101 TIL暴击实体瘤ORR超35%,让晚期肺腺癌患者24周持续缩瘤
GC101是君赛生物自主研发的全球首款无需清淋和白细胞介素-2(IL-2)注射的天然TIL细胞新药。目前公布的临床数据十分亮眼:GC101治疗晚期实体肿瘤的客观缓解率(ORR)超35%,其中4例患者更是奇迹般实现完全缓解(CR),最长无瘤生存时间已超过3年!
尤为值得关注的是一例晚期肺腺癌患者:该患者合并淋巴结、胸膜及骨转移,经放疗+靶向治疗后病情仍持续进展,随后入组接受GC101 TIL细胞回输治疗。
结果令人振奋:在回输后第6周、12周、18周、24周的定期肿瘤影像学评估中,疗效持续显现——第二次增强CT即显示靶病灶缩小36%,最终达到部分缓解(PR);更为惊喜的是,回输24周内,患者未接受其他任何治疗,肿瘤病灶仍在持续缩小,展现出持久的抗癌效果!
▼该患者在接受GC101 TIL细胞回输治疗前,以及治疗6周、12周、18周、24周的CT对比图
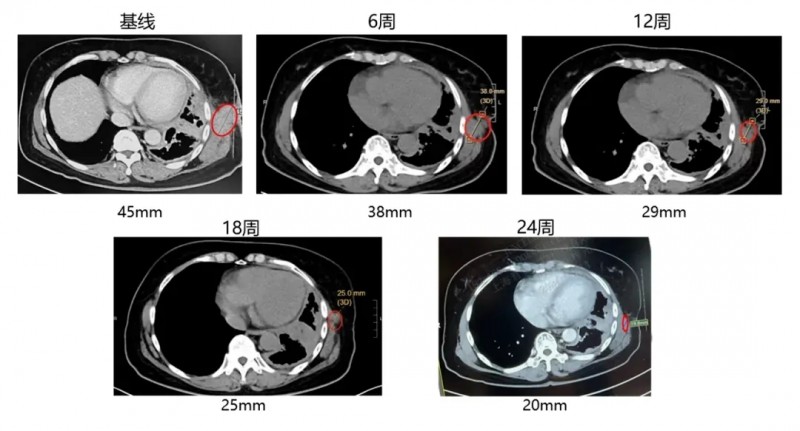
▲图源“JUNCELL”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
十年破冰!CRISPR-TIL疗法剪断免疫枷锁,结直肠癌患者实现超21个月完全缓解奇迹
过去十年间,针对无法治愈的晚期结直肠癌患者,标准化疗方案始终未有重大革新——这类治疗虽能起到姑息效果、改善生活质量,但IV期患者的中位生存期仅20~30个月,因而,突破现有治疗困局的需求迫在眉睫。
如今,《柳叶刀》发表的1期临床试验(NCT04426669)带来了振奋人心的答案:新抗原反应性CRISPR-TIL疗法不仅安全耐受,更展现出显著的早期疗效。该研究纳入12例一线标准治疗失败的转移性胃肠道上皮癌患者,接受CRISPR-TIL细胞治疗后,临床数据亮眼。
结果显示:50%(6例)患者在治疗28天后,达到病情稳定(SD),其中33%(4例)的稳定状态持续至第56天;中位无进展生存期(PFS)达57天(范围:25-156天),中位总生存期(OS)达129天(范围:46-290天)。
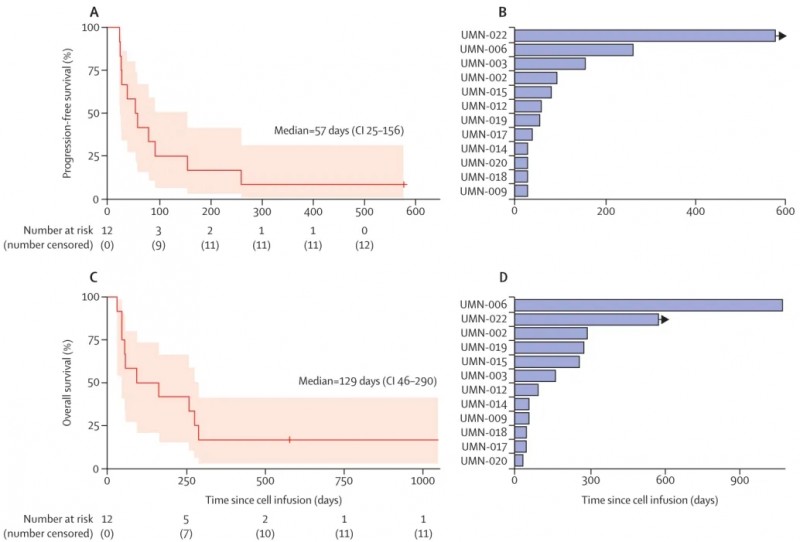
▲图源“LANCET”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
最令人震撼的是一例特殊患者:该患者为微卫星高度不稳定(MSI-H)结直肠癌,且已对PD-1/CTLA-4免疫治疗耐药,接受CRISPR-TIL治疗后,奇迹般实现完全缓解(CR),截至研究公布时,缓解状态已持续超过21个月——其颈部、腹部和肠系膜的转移病灶全部消失(详见下图)!
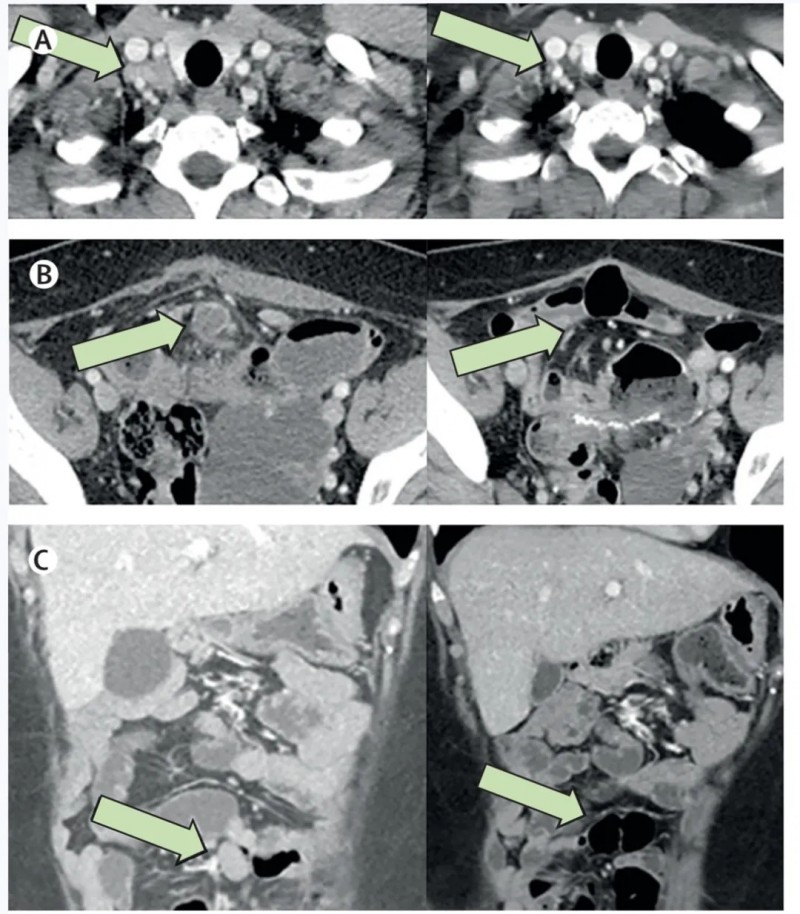
▲图源“LANCET”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
总之,这项研究首次证实,通过CRISPR“基因剪刀”精准敲除TIL细胞内的免疫检查点基因CISH,既能保证治疗安全性,又能显著提升T细胞的抗肿瘤活性,成功攻克了细胞内免疫检查点靶向治疗的难题。更重要的是,它为免疫治疗耐药的晚期转移性癌症患者开辟了全新路径,让曾经“无药可医”的患者看到了长期生存的希望,也为结直肠癌治疗开启了精准免疫治疗的全新篇章!
小编寄语
过去,肿瘤患者手术切除的病变组织,除少量制成病理蜡块用于诊断外,其余大部分都会被当作医疗垃圾丢弃——这无疑是“暴殄天物”,白白浪费了藏在肿瘤里的自身宝贵抗癌免疫细胞!好消息是,现在肿瘤患者只需在术前征得主治医生同意,就能留存新鲜肿瘤组织标本,交由专业机构进行TIL细胞的分离、培养与冻存,让这份“天然抗癌资源”不再被白白浪费。
TIL疗法正是让“以癌治癌”成为现实的精准方案——它源于患者自身,不仅打破了传统治疗的局限,更给无数患者点亮了战胜病魔的新希望,让生命续航之路越走越宽!更令人欣慰的是,近年来我国紧跟国际前沿,多家生物公司纷纷投身TIL产品研发,已有多款产品正式获批开展临床研究,覆盖非小细胞肺癌、乳腺癌、胆管癌、宫颈癌、食道癌、卵巢癌等多种实体瘤。如今,这款救命疗法对中国患者而言,终于不再是遥不可及的奢望!
想寻求TIL疗法帮助的患者,可将近期病理及基因检测结果、治疗经历等资料,提交至医学部,进行初步评估。
参考资料
[1]Jiang Y,et al.1652P A phase I clinical trial of autologous tumor-infiltrating lymphocytes FAST-TIL (HS-IT101) with low-dose IL-2 for the treatment of advanced solid tumors: Subgroup analysis of melanoma[J]. Annals of Oncology, 2025, 36: S979.
https://www.annalsofoncology.org/article/S0923-7534(25)03200-4/fulltext
[2]Chen Y,et al.536 Phase 1 trial of tumor-infiltrating lymphocyte (TIL) therapy in recurrent glioblastoma: A single-center experience using cells derived from primary surgical specimens[J]. 2025.
https://jitc.bmj.com/content/13/Suppl_2/A613
[3]Lou E,et al.Targeting the intracellular immune checkpoint CISH with CRISPR-Cas9-edited T cells in patients with metastatic colorectal cancer: a first-in-human, single-centre, phase 1 trial[J]. The Lancet Oncology, 2025, 26(5): 559-570.
https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(25)00083-X/abstract
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐

胰腺癌实现完全缓解!2026癌症疫苗,T
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
22款肺癌新药扎堆上市!2026这些基因
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
66.7%显著缩小 + 60周持续完全缓
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
"打一针"实现长期生
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

国研双抗突破实体瘤困局!首次人体研究结果
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
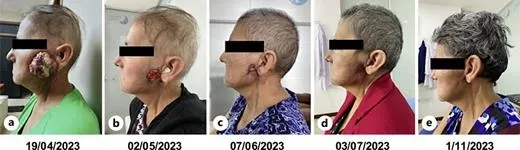
9cm巨大唾液腺肿瘤消失!新型靶向药改写
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




