2025年硬核成绩单!十大国研mRNA疫苗震撼刷屏,从"冷"肿瘤变"热"到4年生存奇迹
2025年癌症治疗硬核成绩单!十大国研mRNA癌症疫苗震撼刷屏,从“冷”肿瘤变“热”到4年生存奇迹
mRNA早在20世纪60年代便已被发现,而新冠疫情的全球大流行,让mRNA新冠疫苗迅速火爆出圈。2020年末,美国FDA率先批准一款新冠mRNA疫苗;2023年,匈牙利科学家卡塔林・卡里科与美国科学家德鲁・韦斯曼,因在mRNA疫苗研究领域的突破性贡献斩获诺贝尔生理学或医学奖,让这项技术获得全球广泛关注。
事实上,mRNA的应用价值远不止于新冠预防。如今,mRNA癌症疫苗研发已成为各国企业的核心竞争赛道,全球范围内,Moderna与默沙东联合研发的mRNA-4157已进入Ⅲ期临床,有望成为首款获批上市的mRNA癌症疫苗。
我国在该赛道紧跟前沿步伐,截至目前,国内已有超20家企业布局mRNA疫苗研发,2025年更是迎来“爆发之年”——从个性化疫苗到通用型疫苗,从特定癌种攻坚到斩获国际认可,多款国研疫苗在临床试验中交出亮眼成绩单,覆盖肝癌、肺癌、胰腺癌、黑色素瘤等高发癌种,实现了从跟跑到并跑甚至局部领跑的跨越式发展。本文特此梳理2025年国研mRNA癌症疫苗的核心临床进展,供癌友们参考。
mRNA癌症疫苗凭四大核心优势,唤醒免疫系统,精准狙击实体瘤
mRNA疫苗即“信使核糖核酸疫苗”,属于癌症治疗性疫苗。理论上,癌细胞携带的突变特异性蛋白(即抗原),会被人体免疫细胞识别并清除。但癌细胞极具伪装能力,常能逃脱免疫系统监视,发生免疫逃逸。而mRNA癌症疫苗通过编码并表达肿瘤特异性抗原(TAA或TSA)及相关细胞因子,可激活人体免疫系统,进而对抗体内癌细胞。其具体作用机制为:疫苗进入细胞后,转录编码特定靶点的mRNA序列,再递送至免疫细胞,最终刺激免疫系统启动应答,促进肿瘤细胞死亡(详见下图)。
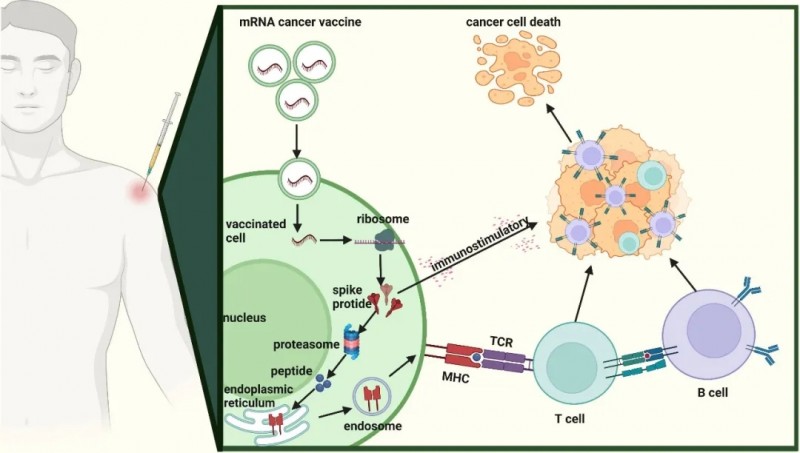
▲图源“frontiers”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
目前,mRNA癌症疫苗已用于治疗非小细胞肺癌(NSCLC)、结直肠癌(CRC)、黑色素瘤等多种侵袭性、转移性实体瘤,核心优势如下:
1、免疫原性强大:兼具体液免疫应答与细胞介导的免疫应答,抗肿瘤作用强劲;既能引发全身免疫反应,对难以手术治愈的转移性肿瘤有效,还能建立并维持长期免疫记忆,降低肿瘤复发风险。
2、支持个性化治疗:通过肿瘤组织取样测序,针对患者癌细胞的特异性抗原或细胞因子定制个性化疫苗,可精准激发抗癌免疫反应,在提升治疗效果的同时减少副作用。
3、安全性较高:生产过程无蛋白质或病毒源性污染,几乎不存在感染风险;且在治疗应用中耐受性良好,注射部位极少出现免疫反应。
4、生产应用高效:mRNA进入细胞质后可直接翻译,无需进入细胞核。相较于其他疫苗技术,它具备生产速度快、灵活性高、成本低廉的优势,能快速研发生产新型疫苗,及时满足临床需求。
2025年十大国研mRNA癌症疫苗突破性进展全景扫描
01、JCXH-211疫苗:我国首款mRNA新抗原疫苗,让"冷"肿瘤变"热"
JCXH-211是我国首款自复制mRNA疫苗,更是全球首个进入临床试验的编码IL-12的自复制RNA药物,同时也是全球首款表达细胞因子的自复制mRNA产品,标志着我国自研mRNA疫苗首次登上世界舞台。
这款疫苗优势显著,既能以较低剂量在体内长效表达IL-12,优先在肿瘤组织中延长其表达(而非正常组织),又能通过调节肿瘤微环境、激活抗肿瘤免疫反应发挥作用,最大限度降低全身毒性;同时还能通过多种机制诱导强效抗肿瘤活性,成功将“冷”肿瘤转化为炎症“热”肿瘤,有效杀伤肿瘤细胞、消除远端肿瘤并预防肿瘤复发,适用于多种晚期实体瘤治疗。2024年7月8日,该疫苗顺利获得美国食品和药品监督管理局(FDA)的IND批准。
同年,在美国临床肿瘤学会(ASCO)年会上,JCXH-211的1a期临床试验(NCT05727839)公布了振奋人心的数据,其在黑色素瘤、乳腺癌、头颈癌、鼻咽癌、肉瘤等多种实体瘤中均展现出强大抗肿瘤活性。该试验共入组10例晚期癌症患者,涵盖3例乳腺癌、3例黑色素瘤、2例头颈癌、1例肉瘤、1例鼻咽癌,分别采用5μg、25μg、50μg三个剂量组进行治疗。
试验结果十分亮眼:3例患者(乳腺癌、头颈癌、黑色素瘤)治疗后病灶明显缩小,缩小率分别为13.0%(5μg组)、33.3%(25μg组)、43.0%(50μg组);值得关注的是,25μg剂量组的头颈癌患者,非注射部位病变也缩小31%,清晰呈现出远端治疗效应。此外,病变组织的病理学分析显示,治疗后患者体内T细胞和NK细胞浸润显著增加,最高增幅达138倍。
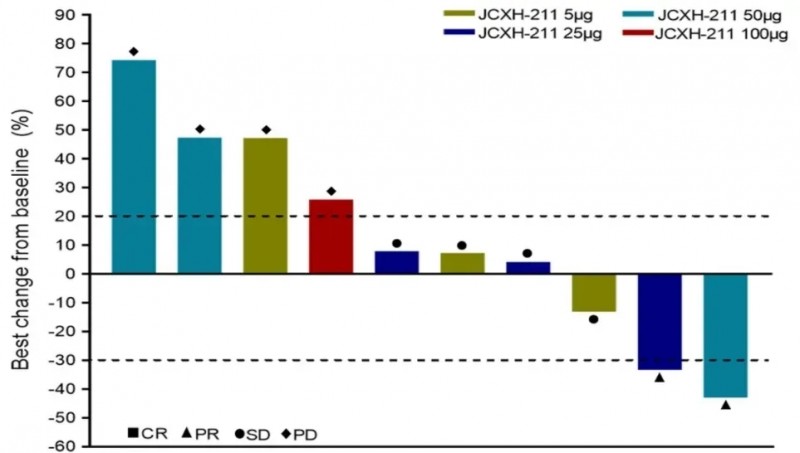
▲图源“JCO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
02、LK101注射液:肝癌生存期超4年
LK101注射液是一款通过编码肿瘤新生抗原的mRNA体外转染树突细胞(DC)制备的疫苗,兼具mRNA疫苗与DC疫苗的双重优势,不仅能为患者带来长期抗癌效应,还具备耐受性好、安全性高的特点。这款疫苗意义重大,既是国内首个获美国FDA IND批准的肿瘤新生抗原mRNA疫苗,也是国内首个获批进入临床阶段的个性化肿瘤新生抗原疫苗,更是首个获批临床的完全个性化mRNA编辑产品,其临床进展堪称行业里程碑!
2023年3月15日,LK101注射液的新药临床试验申请(IND)获国家药品监督管理局药品审评中心(CDE)批准(受理号:CXSL2200612),适应症为晚期实体瘤。
2024年美国临床肿瘤学会(ASCO)大会上,该疫苗治疗肝细胞癌的首次人体临床研究(NCT03674073)数据正式公布,其中复发率与生存期的对比数据尤为振奋人心:疫苗接种组1年复发率18.2%、2年复发率36.4%,对照组则分别高达33.3%和51.4%;两组中位随访时间分别为48.4个月和38.8个月,消融对照组有3名患者死亡,而接种疫苗的12名患者全部存活,意味着他们的生存期已超过4年!

▲截图源自“ASCO”
除了肝癌外,目前,LK101注射液在肺癌治疗领域的探索也已正式启动,主要针对驱动基因阴性(不含KRAS突变)的非小细胞肺癌。感兴趣的病友可致电医学部,进行初步评估或了解详细入排标准。
03、ABO2102:精准打击KRAS突变实体瘤
传统KRAS G12C抑制剂因靶点单一,且无法应对肿瘤微环境的适应性演变,疗效受限,患者中位无进展生存期(PFS)仅6-9个月。而艾博生物研发的新型mRNA癌症疫苗ABO2102,成功打破这一治疗瓶颈。作为编码KRAS新抗原的mRNA纳米颗粒疫苗,其核心优势在于可同时编码五种常见KRAS突变抗原的mRNA序列,能精准覆盖携带任意一种常见KRAS突变的实体瘤患者,尤其适配胰腺癌、非小细胞肺癌、结直肠癌等高发癌种。
ABO2102的作用机制精准高效:mRNA进入细胞翻译后,生成的抗原通过MHCI/II类分子呈递,激活CD8⁺细胞毒性T细胞与CD4⁺辅助性T细胞的双重免疫应答,实现对KRAS突变的精准识别与靶向治疗。相较于仅靶向G12C突变的小分子抑制剂,它不仅覆盖多种KRAS突变类型,还能诱导抗原特异性T细胞持续增殖、建立长期免疫记忆,更可将免疫冷肿瘤转化为免疫反应性肿瘤,突破传统抑制剂的耐药性难题,有望将KRAS靶向治疗从“被动抑制”升级为“主动免疫清除”。
该疫苗的临床试验包含剂量递增阶段(用于确定推荐剂量)与剂量扩展阶段(用于评估抗肿瘤活性),拟单药使用或联合免疫检查点抑制剂(此前探索过与托瑞普利单抗联合,后续获批方向为与信迪利单抗联合),治疗KRAS突变晚期胰腺癌及其他实体瘤患者。同时,凭借“现货型”特性,其应用场景十分灵活:既能用于晚期患者的挽救治疗,也可作为早期患者术后的辅助治疗,还能与化疗、放疗等联合构建多层面协同的肿瘤综合治疗体系。
2025年5月,ABO2102成功获得美国FDA临床试验许可,国内也已通过国家药品监督管理局药品审评中心(CDE)临床默示许可,拟用于治疗KRAS突变的局部晚期或转移性实体瘤。

▲截图源自“NMPA”
好消息是,目前一项针对KRAS突变晚期胰腺癌患者的临床研究正火热招募!该研究旨在评估ABO2102的安全性、耐受性、免疫原性特征及初步有效性,招募对象为晚期胰腺导管腺癌患者。
04、EVM14注射液:肺癌/头颈鳞癌等鳞状细胞癌克星,首例患者已入组
EVM14注射液是云顶新耀基于专有mRNA平台研发的现成治疗性mRNA癌症疫苗,属于不含防腐剂的无菌mRNA-脂质纳米颗粒(mRNA-LNP)制剂。该疫苗由编码5种肿瘤相关抗原(TAA)的mRNA溶液配制而成,封装于脂质纳米颗粒系统中,专门针对鳞状非小细胞肺癌(sq-NSCLC)、头颈部鳞状细胞癌(HNSCC)等多种鳞状细胞癌。
其作用机制清晰高效:肌内注射后,EVM14被抗原呈递细胞(APC)摄取并翻译成靶抗原,这些抗原经加工后通过主要组织相容性复合体(MHC)分子呈递给T细胞,激活后的抗原特异性T细胞可迁移至肿瘤组织,精准识别并杀伤表达靶抗原的肿瘤细胞。临床前研究已证实,EVM14能够诱导免疫记忆、预防肿瘤复发,为患者实现长期无癌生存带来希望。
在临床推进上,EVM14的全球研发进程稳步加速:2025年3月,率先获得美国食品药品监督管理局(FDA)研究性新药申请(IND)批准,成为云顶新耀首个获准开展全球临床开发的自主研发mRNA治疗性疫苗;同年10月14日,该疫苗顺利拿下中国国家药品监督管理局(NMPA)临床试验申请(IND)批准,成为国内首款同时获中美两国监管机构IND批准的mRNA癌症疫苗。同日,EVM14在美国开展的全球多中心I期临床试验完成首例患者入组,这是其在中美IND获批后的又一关键进展,有望通过联合疗法增强疗效、延缓疾病复发,填补现有治疗方案的空白。

▲截图源自“Arena”
05、EVM16:AI算法定制的个性化mRNA疫苗,北肿完成首例患者给药
EVM16是云顶新耀(Everest)自主研发的个性化mRNA癌症疫苗,核心亮点在于依托AI肿瘤新抗原预测算法(EVER-NEO-1算法)进行定制开发。该算法不仅能精准识别大多数已报告的肿瘤新抗原,还可捕捉部分未被记录的新抗原,进而筛选出具有高免疫原性潜力的靶点;再通过脂质纳米颗粒(LNP)递送系统,将编码这些肿瘤新抗原的mRNA高效递送至人体,激活特异性T细胞免疫反应,精准杀伤肿瘤细胞,从而阻断肿瘤生长。
临床前研究中,EVM16展现出强劲的抗肿瘤活性与良好的安全性:在不同试验模型中,注射该疫苗后均诱导产生了强烈的肿瘤特异性T细胞反应,在同基因模型中更是显著抑制了肿瘤生长;且与PD-1抗体联合使用时呈现出优异的协同效应,为临床阶段的联合用药方案提供了坚实依据。此外,临床前毒性研究证实,EVM16重复给药后安全性良好,患者耐受性佳。
2025年3月6日,这款AI辅助研发的个性化mRNA疫苗在北京大学肿瘤医院完成首例患者给药,正式拉开了EVM16首个人体临床试验(CX01)的序幕。此次试验旨在全方位、深层次评估EVM16单药治疗,以及与PD-1抑制剂联合治疗晚期或转移性实体瘤患者时的安全性、耐受性与免疫原性,并探索其初步疗效。

▲截图源自“美通社”
06、WGc-0201:全球首个针对乙肝病毒的mRNA疫苗,疾病控制率达70%
WGc-0201是威斯津生物自主研发的新型mRNA治疗性疫苗,更是全球首个针对乙肝病毒开发的mRNA疫苗。该疫苗以编码乙型肝炎病毒(HBV)相关肝细胞癌(HCC)抗原的mRNA为核心骨架,采用脂质纳米颗粒(LNP)递送技术,专门用于治疗乙肝病毒阳性肝细胞癌。
2025年11月18日,中国国家药监局药品审评中心(CDE)官网传来重磅消息,这款1类新药WGc-0201注射液正式获批临床;此前于同年10月,该疫苗已斩获美国FDA的IND批准,成功实现中美双轨同步推进临床的关键突破!
其首次人体临床试验(NCT05738447)充分验证了WGc-0201的临床价值——在晚期HBV相关肝细胞癌患者中,该疫苗兼具良好的安全性、强劲的免疫原性与令人鼓舞的抗肿瘤活性。该研究共纳入12例肝细胞癌患者,核心数据十分亮眼:10例可评估疗效的患者中,疾病控制率(DCR)达70%;所有剂量组中位无进展生存期(PFS)为2.6个月(95%CI:0.70-4.53)。
▲截图源自“ESMO”
07、AK154:胰腺癌I期临床完成首例患者给药
AK154是康方生物(Akeso)首个进入临床开发的mRNA候选疗法,由公司依托自有mRNA平台研发而成,属于个性化新抗原疫苗。该疫苗通过对肿瘤组织测序,精准识别具有高亲和力的免疫原性突变,进而设计出序列特异性mRNA疫苗,专门用于克服胰腺癌中常见的“冷肿瘤”表型。
临床前研究显示,AK154不仅具备强劲的免疫原性、有效的抗肿瘤活性和良好的安全性,还与康方生物的双特异性抗体在增强抗肿瘤免疫方面展现出协同治疗作用。其中,AK154联合卡度尼利单抗(cadonilimab,PD-1/CTLA-4双抗)或依沃西单抗(ivonescimab,PD-1/VEGF双抗)用药,有望为胰腺癌患者提供全新治疗选择。
2025年11月10日,AK154的I期临床试验完成首例患者给药。该试验聚焦胰腺癌手术切除后的辅助治疗,将同时研究AK154单药疗法,以及其与公司首创的双特异性抗体卡度尼利单抗、依沃西单抗的联合治疗效果。

▲截图源自“PR Newswire”
08、IPM514:晚期食管鳞状细胞癌疫苗
IPM514是臻知医学自主研发的一款现货通用型mRNA肿瘤治疗性疫苗,采用mRNA-LNP技术制备而成。该疫苗通过编码20个肿瘤抗原表位,精准激发特异性抗肿瘤免疫反应,临床前研究证实,其与PD-1抑制剂联合使用时可进一步增强免疫应答效果。
这款疫苗的临床推进速度亮眼:2025年6月率先获得美国FDA批准进入临床,同年9月又顺利斩获中国国家药监局药品审评中心(CDE)的临床批准,拟用于治疗至少经一线系统性抗肿瘤治疗失败的晚期食管鳞状细胞癌(ESCC)。
好消息是,IPM514目前已正式开展临床研究,主要招募二线及以上不可切除的局部晚期或转移性食管鳞状细胞癌患者。
09、TI-0093:首个进入肿瘤治疗领域临床研究的环状RNA(circRNA)药物,重创HPV16阳性实体瘤
TI-0093注射液是圆因(北京)生物研发的一款治疗性癌症疫苗采用全新脂质纳米颗粒(LNP)递送系统,包裹编码经突变及免疫增强修饰的HPV16E7和E6抗原的环状RNA,实现高效靶向递送。它是全球首个进入肿瘤治疗领域临床研究的环状RNA(circRNA)药物,拟用于治疗HPV16阳性的晚期复发或转移性实体瘤。
其作用机制精准且强效:通过肌肉注射给药后,LNP载体将环状RNA顺利送入细胞内,精准编码经免疫优化设计的抗原,不仅大幅提升抗原呈递效率,还能快速启动并高效扩增抗原特异性CD8+T细胞,同时促进肿瘤局部形成活跃免疫浸润,构建强大的“免疫包围圈”,最终介导HPV16阳性进展期肿瘤实现完全缓解并获得持久疗效,展现出高效且特异的免疫调节与抗肿瘤活性。
2025年8月22日,国家药品监督管理局药品审评中心(CDE)官网公示,TI-0093注射液的新药临床试验(IND)申请获得默示许可。这一突破不仅是圆因生物在肿瘤领域临床开发的关键里程碑,更是中国原创新型环状RNA药物在全球竞争中勇立潮头的有力见证。

10、STR-V005:联合PD-1暴击多款实体瘤,首例患者成功给药
STR-V005是星锐医药基于专有LNP-mRNA技术平台开发的个性化肿瘤疫苗,靶向多种肿瘤新抗原(neoantigen),拟联合PD-1药物治疗多种实体瘤。该疫苗借助NeoSTAR抗原预测平台筛选高免疫原性新抗原,再通过高效脂质纳米颗粒(LNP)递送系统包裹编码新抗原的mRNA序列,短期内即可为患者定制生产个体化LNP-mRNA受试品。
其作用机制精准明确:通过激活患者体内的抗原呈递细胞(APC),诱导特异性T细胞激活与增殖,这些T细胞可浸润肿瘤微环境,精准识别并攻击表达特定抗原的肿瘤细胞;同时还能诱导长期免疫记忆,有效降低肿瘤复发与转移风险。目前,该疫苗的临床前及临床初步结果已证实,其具备显著的免疫原性与良好的安全性。
2025年3月,星锐医药宣布STR-V005完成首例患者给药,这一里程碑事件标志着公司该产品管线在临床开发中迈出关键一步。
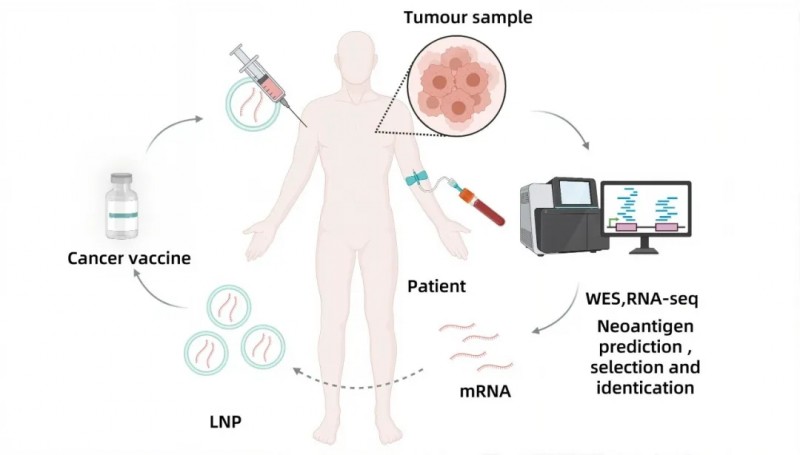
▲图源“starna”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
小编寄语
mRNA癌症疫苗作为癌症疫苗领域的一股清流,既能刺激强烈的免疫反应,又能降低不良反应,增强抵抗癌症的能力!整体来看,2025年国研mRNA癌症疫苗不仅在临床试验数据上实现重大突破,更在国际认可、临床落地和技术创新上全面发力,为癌症患者带来了兼具精准性、安全性和可及性的治疗新希望。
小编也希望,随着癌症疫苗研究的不断深入,未来可以造福更多的患者!想寻求mRNA癌症疫苗、树突细胞(DC)疫苗、古巴肺癌疫苗等新技术帮助的患者,可将近期病理报告、治疗经历、影像学资料等,提交到医学部,进行初步评估或申请国际/国内抗癌专家会诊。
参考资料
[1]A phase I study to evaluate the safety and tolerability of JCXH-211 (a self-replicating mRNA encoding IL-12) intratumoral injection in patients with malignant solid tumors: Results from the phase Ia dose escalation.JCO 42,2539-2539(2024).
https://ascopubs.org/doi/10.1200/JCO.2024.42.16_suppl.2539
[2]Liu J,et al. 1504P An exploratory study on the mRNA WGc-0201 vaccine against advanced hepatitis B related hepatocellular carcinoma in a prospective open-label and first-in-human clinical trial[J]. Annals of Oncology, 2025, 36: S902.
https://www.annalsofoncology.org/article/S0923-7534(25)03054-6/fulltext
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐

【淋巴瘤疫苗招募】WGc-043疫苗剑指
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

4个月婴儿确诊致命脑瘤被判死刑,革命性抗
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

胰腺癌实现完全缓解!2026癌症疫苗,T
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
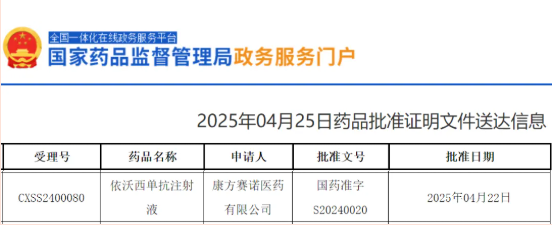
22款肺癌新药扎堆上市!2026这些基因
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
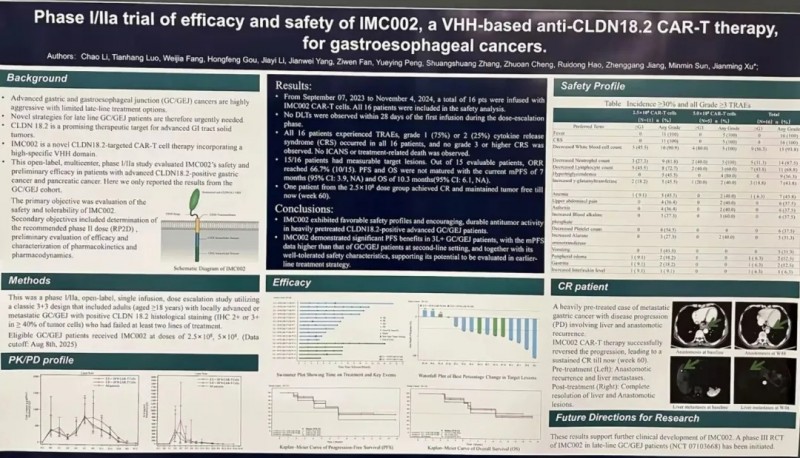
66.7%显著缩小 + 60周持续完全缓
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
"打一针"实现长期生
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05








![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




