重磅!2025诺贝尔医学奖花落细胞领域!从T细胞→mRNA疫苗三连击,最长生存超10年
重磅!2025诺贝尔医学奖花落细胞治疗领域!从T细胞疗法到mRNA疫苗三连击,最长生存超10年
近一个世纪以来,科学家持续探索癌症治疗新方法,核心是调动机体免疫系统参与抗癌;近年来相关临床研究已显振奋成果,癌症免疫疗法也由此成为继手术、化疗、放疗后的第四类抗癌核心技术。
2025年10月6日,2025年诺贝尔生理学或医学奖重磅揭晓,美国科学家玛丽・E・布伦科(MaryE.Brunkow)、弗雷德・拉姆斯德尔(FrederickJ.Ramsdell)与日本科学家西蒙・坂口(ShimonSakaguchi)获奖,表彰他们在外周免疫耐受领域的关键发现——即发现调节性T细胞(Tregs)与免疫耐受相关的FOXP3基因。
这也是诺贝尔奖继2018年关注CAR-T疗法、2022年聚焦mRNA疫苗后,第三次聚焦细胞治疗领域。当免疫细胞的“油门”(激活杀癌功能)与“刹车”(调控Treg细胞)被精准掌控,癌症终将从“不治之症”转为可防、可治、可管的慢性病!

▲图源“OncoDaily”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
2025年诺贝尔生理学或医学奖:Treg细胞研究与免疫疗法新突破
2025年诺奖核心发现
2025年诺贝尔生理学或医学奖聚焦“掌控免疫平衡,精准‘策反’Treg细胞”,三位科学家的贡献如下:
日本科学家坂口志蒙(ShimonSakaguchi):1995年发现调节性T细胞(Tregs),证实其作为“免疫系统保安”,可防止自身免疫攻击;后续进一步发现FOXP3基因调控Tregs发育,揭示免疫系统维持外周耐受性的机制。
美国科学家玛丽・布伦科(MaryE.Brunkow)与弗雷德・拉姆斯德尔(FrederickJ.Ramsdell):2001年发现FOXP3基因突变会导致人类患罕见自身免疫病(IPEX),并在小鼠中引发类似免疫功能障碍。
人类免疫系统关键认知
免疫系统是人体抵御病原体(病毒、细菌等)和异常细胞(如癌细胞)的防御体系,主要分为两类:
1、先天免疫(非特异性防御):通过皮肤、粘膜等物理屏障,巨噬细胞、中性粒细胞等吞噬细胞,以及炎症反应,快速应对病原体入侵。
2、适应性免疫(特异性防御):对病原体产生针对性反应,且具备“记忆”功能,能在病原体再次入侵时高效应对,核心要素包括:①T细胞:作为白细胞,参与识别并摧毁受感染细胞;②B细胞:产生抗体,精准中和病毒、细菌等外来抗原。其中,Treg细胞是维持外周耐受的关键,可避免免疫系统攻击自身组织。
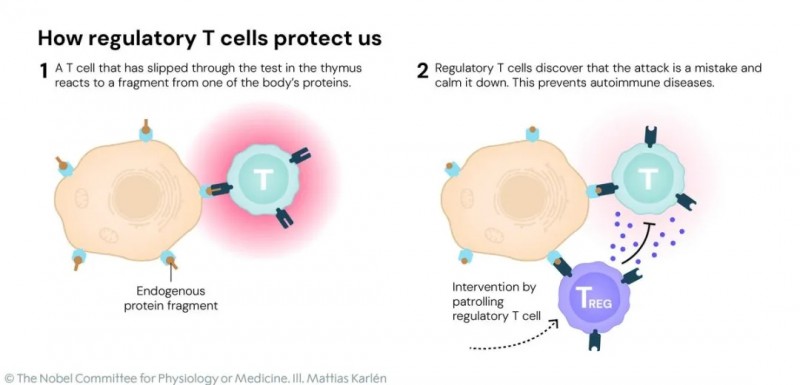
▲图源“Drishtiias”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
Treg细胞发现在癌症治疗中的意义与应用
Tregs堪称免疫系统的“维和人员”,通过维持自身耐受性预防自身免疫反应;其对癌症治疗的意义在于,针对性调控肿瘤周围的Tregs,能显著增强免疫系统对癌细胞的攻击效果。
1、靶向Treg细胞的治疗思路
Treg细胞相关研究为癌症治疗提供新方向:针对性调控肿瘤周围Treg细胞,可解除其对免疫细胞的抑制,增强对癌细胞的攻击效果。
在肿瘤微环境中,部分Treg细胞高表达CD25蛋白,会抑制其他免疫细胞的杀癌功能。基于此,科学家研发出抗CD25单克隆抗体,可精准清除这类“护癌”Treg细胞。当免疫细胞的“油门”(激活杀癌功能)与“刹车”(调控Treg细胞)被精准掌控,且治疗成本随技术进步降低,癌症有望从“不治之症”转变为可防、可治、可管的慢性病。
2、晚期卵巢癌免疫治疗研究案例
晚期上皮性卵巢癌治疗难度大,患者五年总生存率不足40%,急需新疗法突破困境。而近期研发发现,约50%晚期卵巢癌患者外周血中,可检测到肿瘤特异性T细胞前体,提示免疫疗法或能改善患者预后。
《肿瘤免疫学》报告的一项研究验证了该观点。该研究共入组7例平均年龄55岁(46-69岁)的晚期卵巢癌患者,先使用抑制Treg功能与肿瘤血管生成的药物,再注射经自体肿瘤细胞裂解物上清液脉冲的树突状细胞(DC)疫苗;其中1例因未生成足够树突状细胞未接种疫苗。
结果显示:依据实体瘤疗效评价标准(RECIST)1.1评估,2例患者实现部分缓解(PR),2例病情稳定(SD)。其中1例患者在三级减瘤手术后入组时无疾病证据(NED),研究期间持续缓解,后续每4周接受疫苗加强针联合贝伐单抗治疗,14个月内维持无病状态(该患者此前对贝伐单抗无响应)。
值得一提的是,S-01号患者的治疗效果尤为突出,该患者在接种疫苗后至少达到病情稳定(SD),对比接种DC疫苗前的CT影像(左图)与接种后的影像(右图),可见其左主动脉旁淋巴结出现退化(详见下图)。
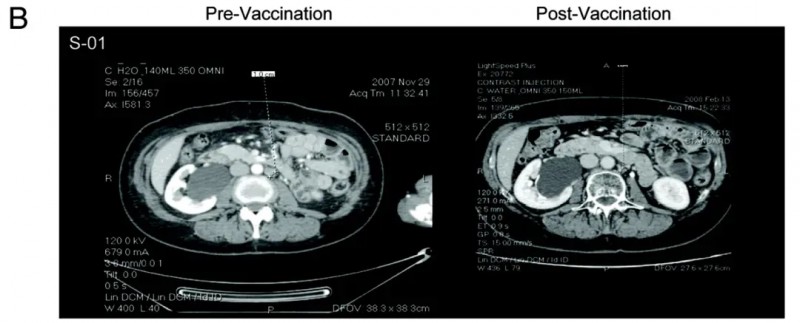
▲图源“Oncoimmunology”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
2018年诺奖与癌症免疫治疗:用免疫检查点疗法解锁T细胞抗癌力,打破癌细胞"伪装"
2018诺奖:让T细胞挣脱"枷锁",重启杀癌模式
2018年随着两位发现免疫检查点抑制癌症疗法的科学家JamesP.Allison(詹姆斯•P•艾利森,发现T细胞抑制受体PD-1)、TasukuHonjo(本庶佑,证实CTLA-4抗体可增强免疫并治疗肿瘤),获得诺贝尔生理学或医学奖,让癌症免疫治疗引起了广泛关注!
此前,癌细胞会利用免疫系统的“检查点”机制,向T细胞发送“别攻击我”的信号,如同给T细胞戴上“枷锁”,使其无法发挥杀癌作用。而免疫检查点抑制剂能打破这一“枷锁”,让T细胞重新识别并攻击癌细胞。

免疫系统与癌细胞的"博弈"
免疫系统是一个复杂的网络,由免疫细胞(如T细胞)、免疫组织(如骨髓)、免疫器官(如胸腺)、免疫分子组成,可主动检测并清除“异己”,包括来自外部(如细菌、病毒)、内部(如癌细胞、衰老细胞)的各种威胁,这一功能即为“免疫监视”。
然而癌细胞非常狡猾及难以清除,首先,癌细胞会通过改变组织相容性复合体(MHC)、分泌糖蛋白或黏多糖等手段进行伪装,以躲过肿瘤的免疫监视;其次,癌细胞会不断进化,使免疫系统更难以识别;最后,癌细胞具有超强的繁殖速度,这也会增加清除难度。
因此,只有当免疫系统比肿瘤更加强大时,才有可能打败它们。而癌症免疫治疗的核心是通过增强人体自身免疫系统,杀伤并控制肿瘤,目前主要分为三类:免疫检查点阻断剂、过继性细胞疗法、癌症疫苗。
其中,肿瘤过继性T细胞疗法(ACT)是重要分支:它从患者或供者体内提取T淋巴细胞,经体外筛选、基因修饰等步骤“训练”成免疫“战士”,赋予其肿瘤杀伤活性后回输患者体内,进而杀伤肿瘤。注:下图展示剑桥大学团队与美国国立研究所,通过晶格层光显微镜技术拍摄的T细胞(红色)与癌细胞(蓝色)“殊死搏斗”场景。
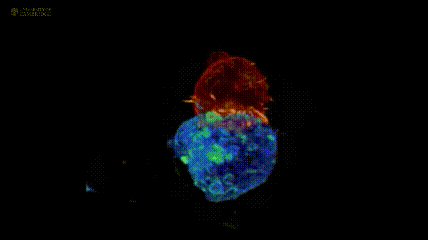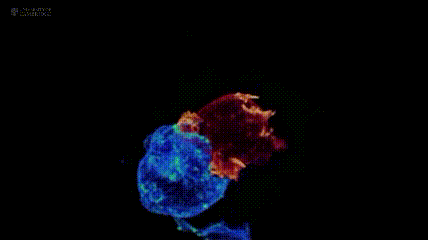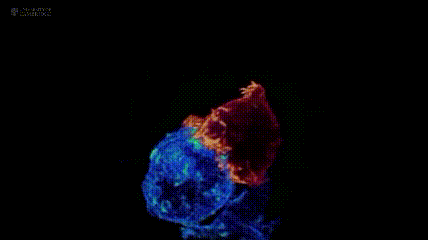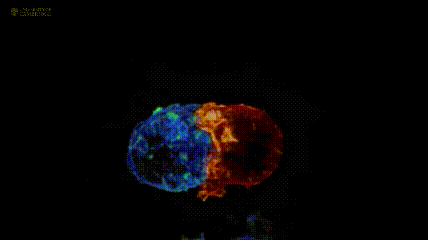
肿瘤过继性T细胞疗法(ACT)主要包括CAR-T、TIL、TCR-T三种,且三者均有产品获批上市,为实体瘤及血液肿瘤患者带来新的生存希望。其中,肿瘤浸润淋巴细胞(TILs)是从肿瘤组织中提取的免疫细胞。研究发现,从肿瘤组织分离的免疫细胞,超60%可识别肿瘤;而从血液中分离的免疫细胞,这一比例不足0.5%。因此,与提取自血液的CAR-T、TCR-T相比,TIL细胞对实体瘤的杀伤能力更强,被称为“实体瘤圣斗士”。
全球首款无需清淋的TIL:晚期实体瘤ORR超35%,肺癌缩小36%
以全球首款无需清淋和白细胞介素-2注射的天然TIL细胞新药GC101为例,其在晚期实体肿瘤治疗中展现卓越疗效:客观缓解率(ORR)超过35%,其中4例患者实现完全缓解(CR),最长无瘤生存时间已超3年,为患者带来了持久的生存希望。
尤为亮眼的是,其中一位合并淋巴结、胸膜及骨转移的晚期肺腺癌患者,在接受GC101回输后,增强CT显示靶病灶缩小36%(达部分缓解PR);且回输后24周内未接受其他治疗,肿瘤仍持续缩小,体现出GC101强大且持久的抗肿瘤活性。下图为该患者接受TIL回输前、治疗6周/12周/18周/24周的CT对比图。
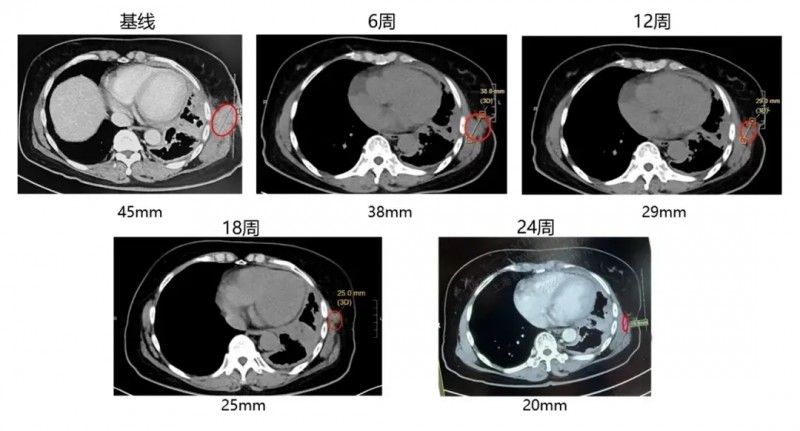
▲图源“JUNCELL”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
TIL联合PD-1:胃肠道肿瘤治疗新突破,最长存活超10年
TIL疗法不仅能“单打独斗”,与PD-1抗体联合使用还能进一步增强抗癌效果。2025年4月,《Nature Medicine》发表美国国家癌症研究所(NCI)的重磅研究,由TIL疗法奠基者StevenA. Rosenberg教授领衔,共纳入91例难治性、错配修复功能正常的转移性胃肠道癌患者。
结果显示:73例可评估患者中,11例(15.1%)实现确认的部分缓解(PR);单药组(SEL-TIL)肿瘤显著缩小比例为7.7%(95%CI:2.7–20.3),联合组(SEL-TIL+P)达23.5%(95%CI:12.4–40.0)。在长期生存方面,4例患者生存期超48个月,分别延长至126个月、106个月、86个月、76个月;其中1例联合治疗患者最长存活超10年。
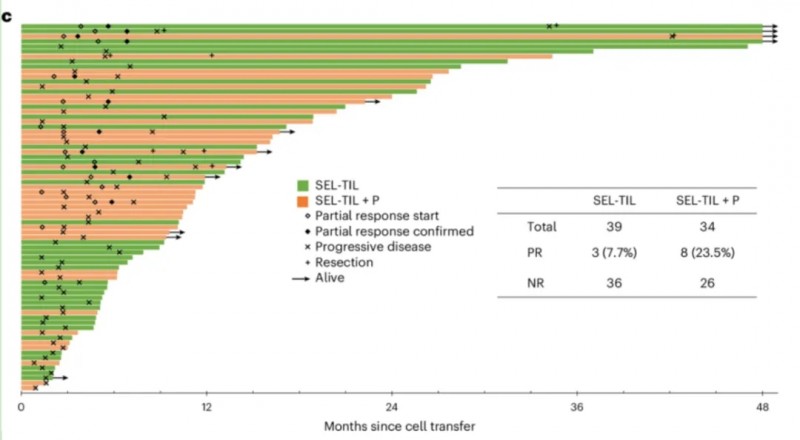
▲图源“Nat Med”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
值得一提的是,一例结肠癌患者,在治疗7个月时,右肺、左肺两处结节完全消退,其余结节也缩小。
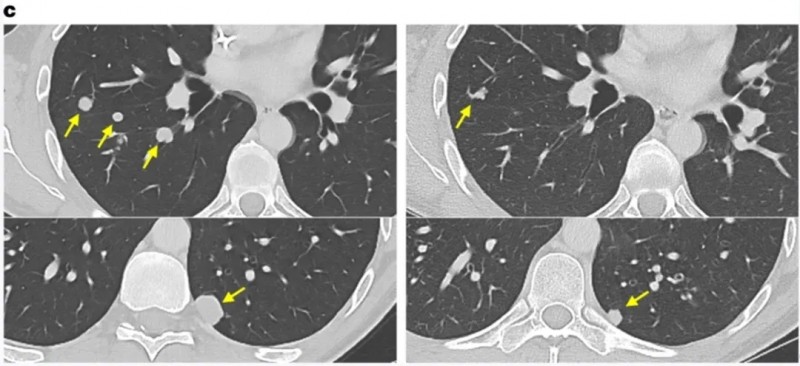
▲图源“Nat Med”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
2023年诺奖与mRNA疗法:从新冠防控到癌症治疗的突破
2023年诺奖:mRNA疫苗的"奠基性发现"
2023年10月2日,美国科学家卡塔琳・考里科(KatalinKarikó)与德鲁・韦斯曼(DrewWeissman)因在核苷碱基修饰领域的突破性发现,被授予2023年诺贝尔生理学或医学奖,这一发现直接推动了高效COVID-19mRNA(信使核糖核酸)疫苗的研发。
他们的研究彻底改变了人类对mRNA与免疫系统相互作用机制的认知,在新冠大流行期间为mRNA新冠疫苗的快速研发提供了关键支撑,让这类疫苗得以广泛应用。而mRNA技术的价值远不止于新冠防控,其核心原理是通过向体内递送抗原信息、引导免疫系统产生特异性免疫反应,并很快被拓展至癌症治疗领域。

▲图源“WHYY”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
mRNA癌症疫苗:唤醒免疫,识别癌细胞
事实上,mRNA早在20世纪60年代便被发现,如今mRNA癌症疫苗研发已成为全球竞争赛道,尤其在实体瘤治疗中展现出广阔前景,如非小细胞肺癌(NSCLC)、结直肠癌(CRC)、黑色素瘤等。
mRNA癌症疫苗属于治疗性疫苗,其作用原理围绕“破解癌细胞免疫逃逸”展开:癌细胞携带的基因突变特异性蛋白(即抗原),本应被人体免疫细胞识别并清除,但癌细胞擅长伪装,常能躲避免疫监视(即“免疫逃逸”)。而mRNA癌症疫苗可通过编码、表达肿瘤特异性抗原(TAA或TSA)及相关细胞因子,主动激活人体免疫系统,让免疫细胞精准识别并对抗癌细胞。
想寻求LK101或其他癌症疫苗帮助的患者,可将治疗经历、近期病理检查及影像学检查结果等资料,提交至医学部,进行初步评估。
mRNA癌症疫苗中国研发的重磅突破
近年来,我国在mRNA癌症疫苗研发领域取得关键进展。其中,LK101注射液作为中国首个获NMPA(国家药品监督管理局)批准进入临床的个性化肿瘤新生抗原疫苗,同时也是首个获批临床的完全个性化mRNA编辑产品,于2023年3月17日通过NMPA药品审评中心临床试验默示批准。
2024年美国临床肿瘤学会(ASCO)大会上,该疫苗“治疗肝细胞癌(HCC)的首次人体临床研究(NCT03674073)”数据公布,进一步证实了mRNA癌症疫苗的疗效。
结果显示:LK101联合消融疗法安全性可控,且存在明确的免疫激活证据,同时展现出延长生存期的潜力。其中复发率对比尤为显著:疫苗接种组1年复发率为18.2%、2年复发率为36.4%,对照组则分别为33.3%、51.4%。两组中位随访时间分别为48.4个月(疫苗接种组)和38.8个月(对照组),对照组已有3名患者死亡,而疫苗接种组12名患者均存活——这意味着所有接受疫苗治疗的患者生存期均已超过4年!

▲截图源自“ASCO”
小编寄语
从实验室对Treg细胞的最初发现,到癌症患者长期无瘤生存,诺贝尔奖丈量的不仅是科学突破的高度,更是人类对抗癌症的决心。
但癌症作为一种高度突变且狡猾的复杂疾病,目前很难通过单一治疗手段达到预期效果。首先,手术、化疗、放疗这三大传统治疗的中流砥柱地位无法撼动。尽管技术进步让传统抗癌手段取得了不同程度的提升,但仍未能解决癌症复发与转移两大核心难题。其次,新兴抗癌疗法的作用同样重要,尤其是以过继性细胞疗法、癌症疫苗、免疫检查点抑制剂为代表的肿瘤免疫疗法,近年已逐渐成为“抗癌新星”。它通过调动机体自身免疫力,遏制癌症复发与转移:一方面可作为术后辅助治疗,增强患者免疫力,帮助清除术后残留癌细胞、抑制肿瘤复发、巩固治疗效果;另一方面能与化疗、靶向药等其他疗法联合使用,提升抗癌效果,最大程度延长患者生存期、改善生活质量。
如果您想寻求CAR-T、TCR-T、TIL疗法、癌症疫苗等抗癌免疫疗法的帮助,或对目前的治疗方案不满意,可联系医学部,初步评估病情,或申请国内外专家会诊。
参考资料
[1]Kandalaft LE,et al.Autologous lysate-pulsed dendritic cell vaccination followed by adoptive transfer of vaccine-primed ex vivo co-stimulated T cells in recurrent ovarian cancer. Oncoimmunology. 2013 Jan 1;2(1):e22664.
https://pmc.ncbi.nlm.nih.gov/articles/PMC3583933/
[2]Lowery F J,et al.Neoantigen-specific tumor-infiltrating lymphocytes in gastrointestinal cancers: a phase 2 trial[J]. Nature medicine, 2025: 1-10.
https://www.nature.com/articles/s41591-025-03627-5
[3]https://www.drishtiias.com/daily-updates/daily-news-analysis/nobel-prize-in-physiology-or-medicine-2025
[4]https://oncodaily.com/blog/nobel-prize-in-physiology-or-medicine-2025
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐

4个月婴儿确诊致命脑瘤被判死刑,革命性抗
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

胰腺癌实现完全缓解!2026癌症疫苗,T
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
22款肺癌新药扎堆上市!2026这些基因
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
66.7%显著缩小 + 60周持续完全缓
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
"打一针"实现长期生
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

国研双抗突破实体瘤困局!首次人体研究结果
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05








![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




