100%缓解率!北大自研现货型CAR-T身披"隐身衣"登《Cell》,横扫血癌、肺癌、卵巢癌、肠癌等
身披"隐身衣"的北大自研现货型CART细胞疗法登上《Cell》,横扫血癌、肺癌、卵巢癌、肠癌等
过去十年,自体CAR-T疗法在血液系统恶性肿瘤治疗中取得革命性突破:多款针对CD19、BCMA的产品已获批,在复发/难治性白血病、淋巴瘤及多发性骨髓瘤中展现高缓解率,部分患者甚至实现长期治愈,奠定了其精准免疫治疗“明星疗法”的地位。但该疗法依赖患者自体T细胞,存在生产流程复杂、储运要求高、周期长(2-4周)、成本高昂等问题。
为突破上述瓶颈,“现货型”同种异体(通用型)CAR-T疗法应运而生——通过改造健康供体T细胞后输注患者,可实现规模化、现货化生产,然而多数同种异体CAR-T需采用TCR删除策略,却会削弱T细胞持久性。
基于此,2025年8月,北京大学与解放军总医院愿景团队在《Cell》发表研究,为解决上述难题提供了新方向,通过鉴定糖基化调控基因SPPL3提出“糖盾护体”策略。在对3例淋巴瘤/白血病患者的同情治疗中,未观察到GvHD临床症状,有望推动通用型CAR-T真正迈入“现货治疗时代”,免去了患者痛苦等待制备的时间!
▲截图源自“Cell”
T细胞"披甲上阵"!国研"现货型"CAR-T落地临床,刷新淋巴瘤疗效记录
SPPL3成破局关键,利用基因编辑为CAR-T穿上"隐身衣",一举攻克同种异体疗法"三座大山"
利用健康供体T细胞改造的同种异体CAR-T,可实现现货化、规模化生产,是自体CAR-T极具前景的替代方案。但要使其持久发挥疗效,需跨越三重核心阻碍,这些均可能导致疗效衰减:
1、移植物抗宿主病(GvHD):供体CAR-T输注后将患者组织视为“异物”发起攻击;
2、宿主抗移植物反应(HvG):患者自身T细胞及NK细胞将异体CAR-T当作“外来者”直接清除;
3、活化诱导的细胞死亡(AICD):反复免疫刺激后,CAR-T通过Fas/FasL途径启动程序性死亡。
为破解上述免疫互斥难题,魏文胜团队借助全基因组CRISPR敲除文库筛选发现:降低HLA-ABC识别、增强NK细胞抵抗、提升细胞存活这三类目标表型,均指向同一关键基因——SPPL3。此前研究亦证实,SPPL3缺失可使肿瘤细胞抵抗CAR-T攻击,提示其在免疫耐受中的核心作用。
SPPL3是定位于高尔基体的膜内切割酶,通过抑制糖基转移酶和糖苷酶活性,负向调控细胞表面糖链合成。敲除该基因后,T细胞表面会形成致密糖基修饰层——即“糖苷盾”(或称“免疫隐身衣”),通过三重机制实现保护:一是减少NK细胞活化配体,增强抗NK杀伤能力;二是降低Fas分子可及性,抑制AICD发生;三是减少HLA-I分子暴露,削弱宿主T细胞通过TCR的识别(类似遮盖“身份标签”,使宿主无法识别)。
关键在于,SPPL3编辑不会损害CAR-T的抗肿瘤效能:体外实验中,其抵抗AICD、NK杀伤及宿主T细胞清除的能力显著提升;动物模型中,可完全清除肿瘤并延长生存期,且抗CD19 CAR功能不受影响。
临床层面,I期临床试验(NCT06014073)显示,9例复发/难治性B细胞非霍奇金淋巴瘤患者接受治疗后达到主要安全性终点,仅3例出现3级及以上细胞因子释放综合征(CRS)。
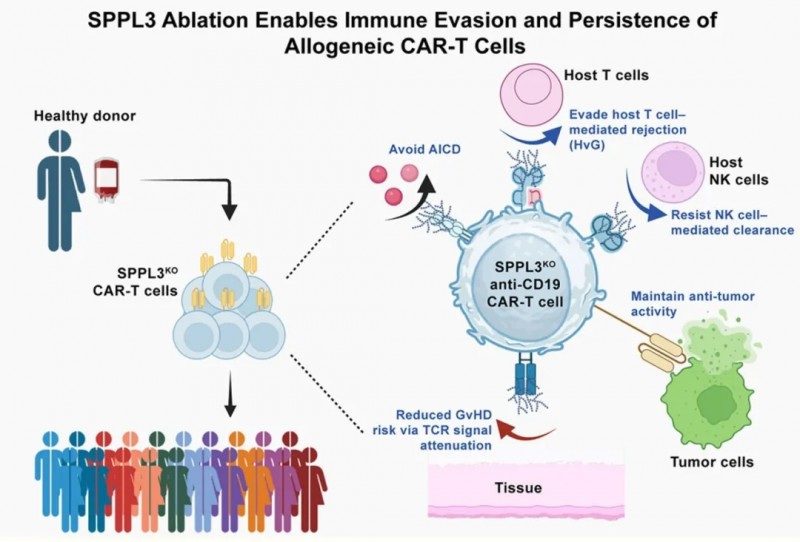
▲图源“Cell”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,SPPL3是促进同种异体T细胞持续存在的重要基因靶点。用受SPPL3调控的聚糖掩盖通用T细胞,可以保护它们免受细胞和可溶性免疫效应物的侵害,并导致这些细胞在人体中早期高度扩增。该研究提出的SPPL3靶向编辑策略,不仅保留TCR功能、证实了通用型CAR-T的可行性(图四),还为γδT细胞、NK细胞等通用型细胞治疗提供了分子改造靶点,有望加速“现成即用”免疫疗法的转化应用。
中国新型"隐身衣"CAR-T暴击难治性淋巴瘤,100%缓解,66.7%完全缓解
我国研究团队开展了一项I期临床试验(NCT06014073),旨在评估改造后披上“隐身衣”的这款同种异体CAR-T细胞疗法,对复发/难治性(r/r)B细胞非霍奇金淋巴瘤(B-NHL)的安全性与耐受性。该研究共入组9例受试者,均接受SPPL3基因敲除(SPPL3KO)/T细胞受体敲除(TCRKO)抗CD19CAR-T细胞输注。
结果显示:9例受试者的客观缓解率(ORR)达100%,完全缓解率(CR)为66.7%,部分缓解率(PR)为33.3%(图5D、5E);截至2024年12月31日,中位缓解持续时间为2.2个月(范围0.8-7.3个月),其中3例维持缓解超6个月。具体来看:
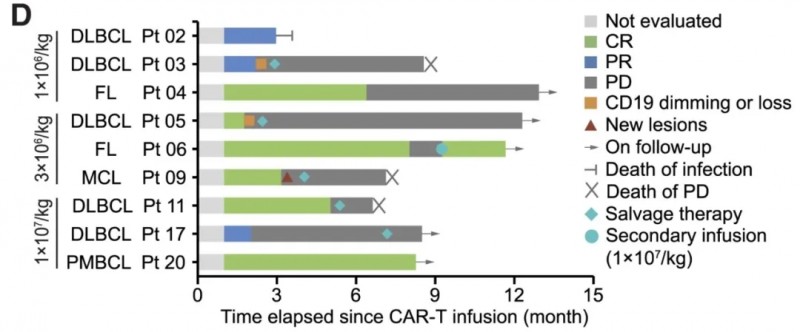
▲图源“Cell”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
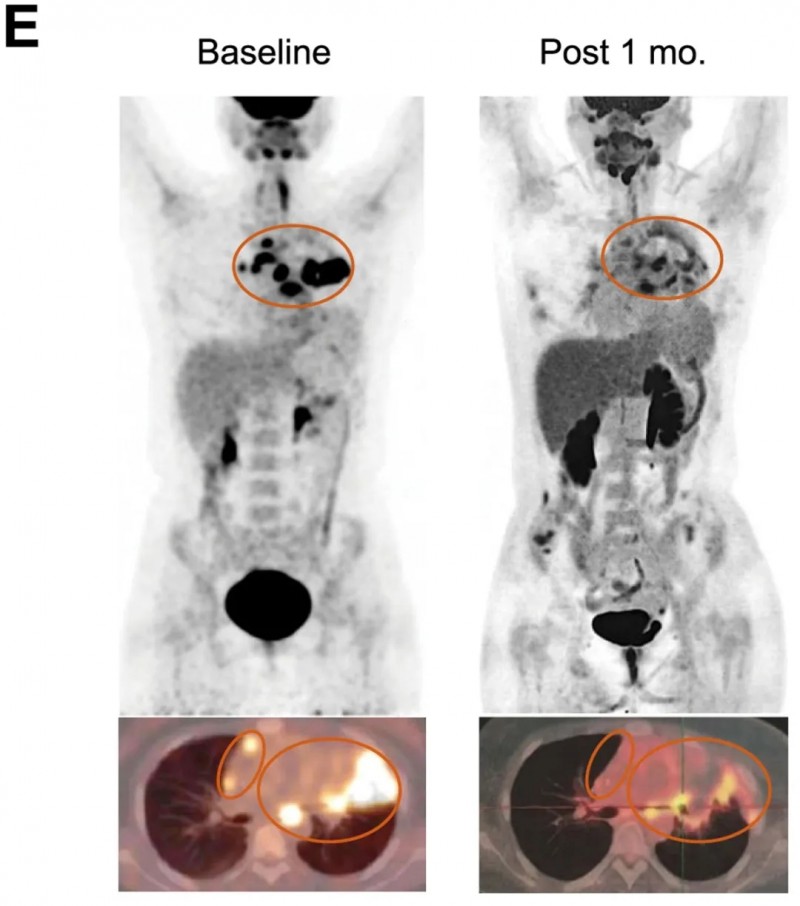
患者01:曾接受自体CD19/CD20 CAR-T治疗,病情进展后接受上述新型CAR-T细胞同情治疗。
结果显示:输注1个月后,肿瘤几乎完全根除(详见下图),PET-CT及CT图像对比显示了该患者接受自体CAR-T与“糖盾”CAR-T治疗后的疗效差异。同时伴随CAR-T细胞大量扩增及肿瘤部位明显炎症反应。
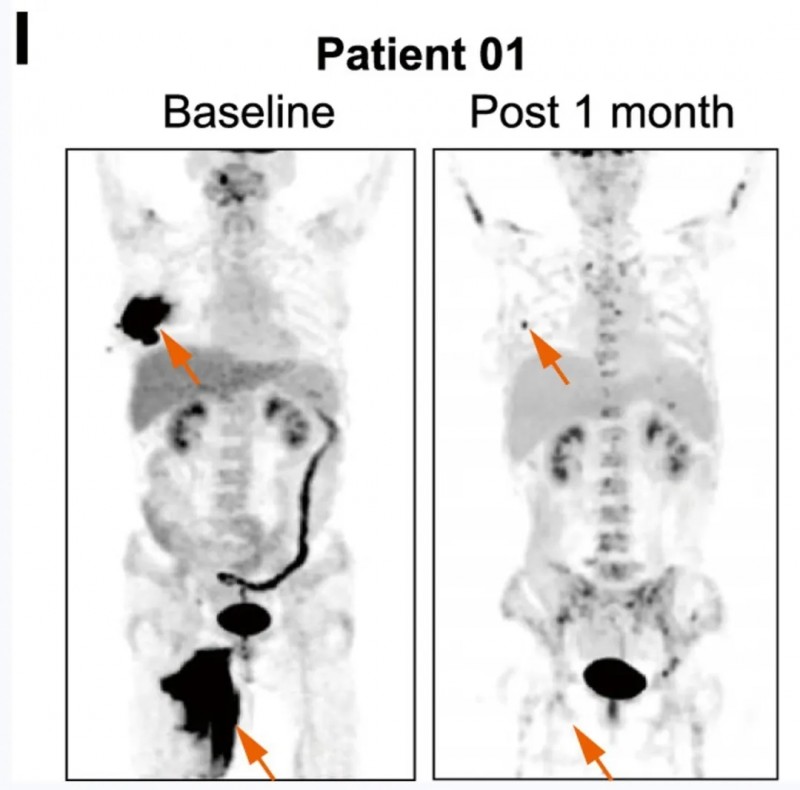
▲图源“Cell”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
患者C01:33岁女性,诊断为弥漫大B细胞淋巴瘤,三线全身化疗后接受同情用药。结果显示:输注新型CAR-T细胞1个月后,达完全缓解(CR),并在3个月、6个月时维持CR(详见下图)。
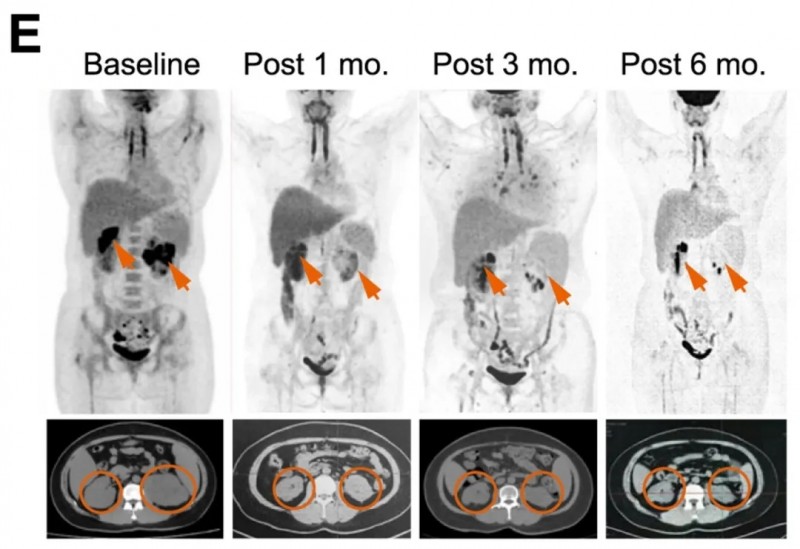
▲图源“Cell”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
患者C02:是一位27岁女性,诊断为原发性纵隔大B细胞淋巴瘤,接受这款新型CAR-T同情用药。结果显示:输注1个月后,达部分缓解(PR)(详见下图)。
▲图源“Cell”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
患者C03:是以为34岁男性,患有高危混合谱系白血病(MLL)-重排B细胞急性淋巴细胞白血病(B-ALL),接受完全HLA错配(0/12)无关供体的SPPL3KO抗CD19CAR-T治疗。
结果显示:输注后14天、28天均达微小残留病(MRD)阴性的完全缓解(计数未完全恢复,CRi)(详见下图)。
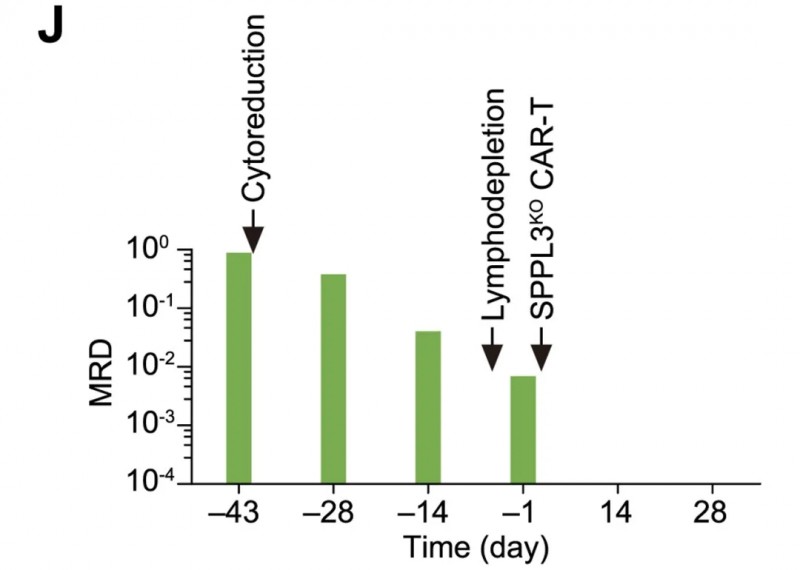
▲图源“Cell”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,本研究证实:这款新型CAR-T细胞可在r/rB-NHL患者体内成功扩增,并持续存在,有效控制肿瘤,为多线治疗失败或难治性B细胞恶性肿瘤患者提供了潜在治疗选择。
从"病情反复"到"稳定缓解"!我国自研MSLN靶向CAR-T,助晚期卵巢癌患者病灶缩小近半,生存期超17个月
间皮素(MSLN)在多数上皮性卵巢癌(EOC)中高表达,针对该靶点的CAR-T细胞、免疫检查点阻断剂及抗血管生成药物阿帕替尼等,已用于难治性卵巢癌治疗。我国研究人员据此开发出αPD-1-mesoCAR-T细胞疗法,其携带编码MSLN特异性单链可变片段及PD-1全长抗体的序列。
《癌症免疫治疗杂志》报道一个振奋临床案例:一位54岁女性,初诊Ⅲc期晚期卵巢浆液性腺癌。2015年9月接受减瘤术后,先后行一线紫杉醇+顺铂、二线吉西他滨+奥沙利铂化疗;2017年8月MRI发现肝脏新发病灶,后病情稳定(SD)。此后予脂质体阿霉素+奈达铂治疗,2018年3月因CA125升高、肝脏病灶增大改为阿帕替尼,CA125下降且病情稳定8个月。2018年10月CA125再升高,MRI示肝脏2个可测量结节(肺、盆腔无转移);肿瘤检测示微卫星稳定、19个常见肿瘤相关基因无突变,MSLN高表达(+++,84%),遂入组αPD-1-mesoCAR-T临床试验(NCT03615313)。
结果显示:两次CAR-T治疗后2个月,肝脏MRI示转移结节平均直径从71.3mm缩至39.1mm(详见下图B),肝转移灶获协同抑制;联合阿帕替尼2个月内CA125下降,患者达部分缓解(PR),生存期超17个月,副作用轻微。
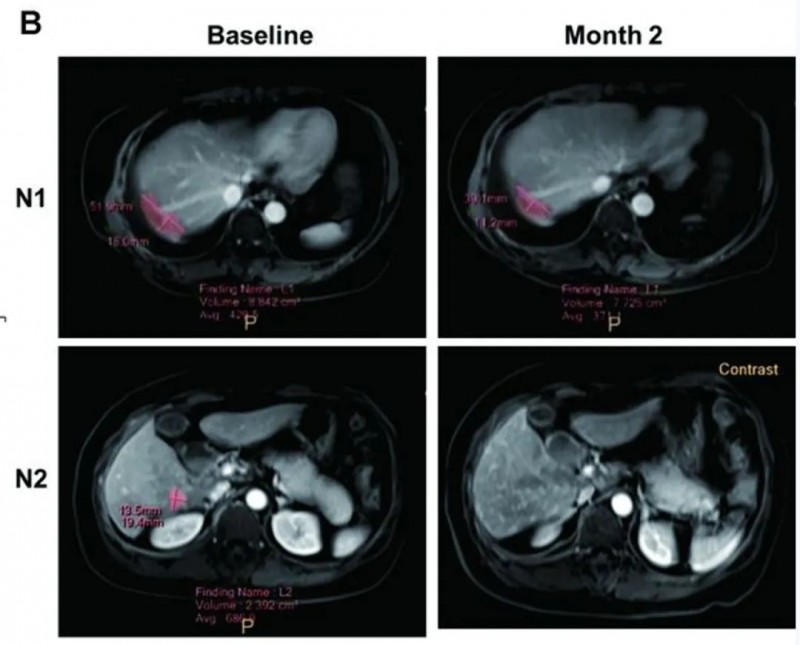
▲图源“BMJ”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
精准锁定CEA靶点!我国自研CAR-T暴击结直肠癌,70%患者病情稳定
癌胚抗原(CEA)在正常上皮细胞管腔顶端膜面低水平表达(此区域难被免疫细胞触及),而在结直肠癌(CRC)组织及血清中广泛表达,使其成为CAR-T疗法的理想靶点。
我国开展的CEA CAR-T治疗CEA阳性CRC的I期临床试验(NCT02349724)数据振奋:疗法耐受性良好,多数患者显效,为CRC精准免疫治疗开辟新路径,也提升了CAR-T在实体瘤领域的应用潜力。
该研究纳入10例转移性CRC患者,中位年龄58岁(48.8-67岁):80%(8/10)合并肝转移,50%(5/10)合并肺转移;8例曾行原发病灶肠切除术,中位化疗线数2.5线(1.25-3线)。所有患者均静脉输注CEA CAR-T,其中4例(P1、P7、P9、P10)接受两次不同剂量输注,其余6例仅输注一次。
结果显示:10例既往治疗进展(PD)的患者中,7例经CAR-T治疗后病情稳定(SD)、肿瘤直径微变,其中P3、P5的稳定状态超30周(7.5个月)。两例典型病例疗效尤为显著:P10接受DL4剂量治疗后,MRI证实肝内一处病灶缩小(详见下图C);P9-2经PET/CT检查显示肿瘤活动减弱、代谢活性显著降低(详见下图B)。
▼P10患者在CAR-T治疗前(左图)、治疗4周后(右图)的MRI对比
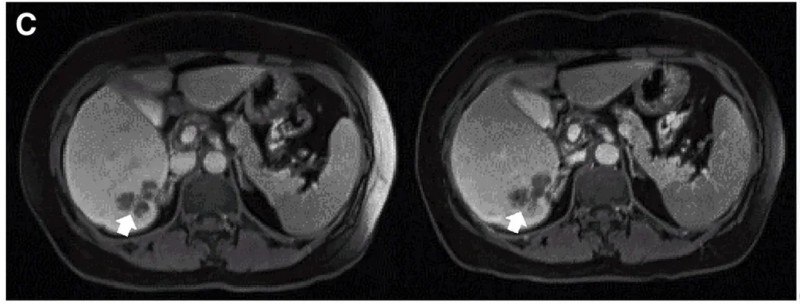
▲图源“Molecular Therapy”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
▼P9-2患者在CAR-T输注前(左图)、治疗4周后(右图)的PET/CT对比
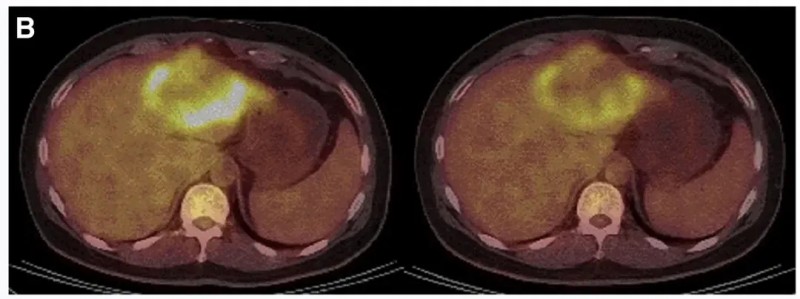
▲图源“Molecular Therapy”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
LB2102 CAR-T让多线治疗失败的小细胞肺癌患者,从"无药可选"到"有效控制",疾病控制率达70%
在2025年WCLC大会上,研究团队公布了LB2102(一种DLL3导向的自体CAR-T细胞疗法)用于复发或难治性小细胞肺癌(SCLC)或大细胞神经内分泌癌(LCNEC)患者的1期临床试验初步结果。
试验共纳入17例患者,中位年龄55岁(范围20-68岁),中位既往治疗线数2条(范围1-5条);最终12例患者(基线DLL3表达平均值为86%)接受了4个剂量水平的LB2102治疗,其中10例为小细胞肺癌(SCLC)患者,2例为大细胞神经内分泌癌(LCNEC)患者。从患者血液分离到接受LB2102治疗的中位时间为87.0天,中位随访时间为120.5天。
结果显示:按RECIST1.1标准评估:患者肿瘤大小最佳总体变化中位数为-19.1%(不同剂量水平具体范围详见图1);在10例可评估疗效的患者中,客观缓解率(ORR)达20%,疾病控制率(DCR)达70%。
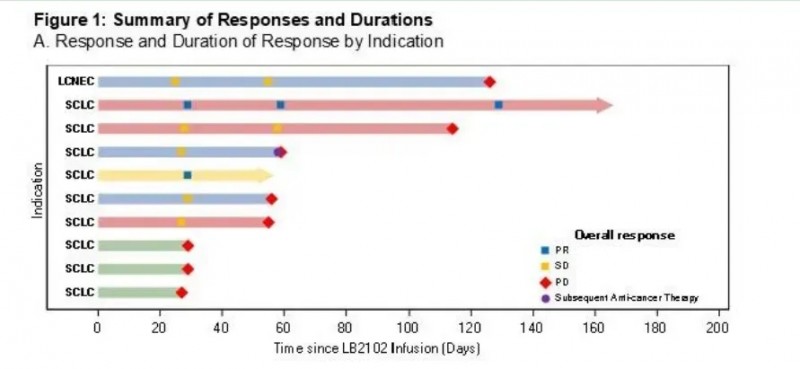
▲图源“WCLC”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
小编寄语
十二年前,急性淋巴细胞白血病患儿Emily Whitehead在接受CAR-T细胞疗法治疗后,获得临床治愈,并存活至今的案例让CAR-T这款新型免疫细胞疗法一战成名!如今,我们很欣慰的看到,全球已有12款CAR-T产品获批上市,为无数饱受疾病折磨的血液肿瘤患者带来了新的希望与曙光!
更加欣慰的是,各国都纷纷加入CAR-T研发大军中,截至2023年,全球免疫细胞的临床研究项目已超2000项(ClinicalTrials.gov),其中仅CAR-T疗法一项就占据了近半数以上,这也彰显了CAR-T疗法在抗癌领域的广阔应用前景。而且近年来,研究人员不断更新CAR-T的新技术、发现新的靶点,尝试将其用于实体瘤治疗领域,并取得了不俗的疗效。医学部小编希望CAR-T疗法可以早日突破价格和实体瘤治疗瓶颈,让越来越多的癌症患者获益,助其降低复发风险、实现长期带瘤生存的美好愿景!
如果您也想寻求CAR-T、TCR-T、TIL、CAR-NK等国内外新型抗癌疗法的帮助,可将近期影像学检查结果、近期病理报告、治疗经历等资料,提交至医学部,详细评估病情,或申请国内外抗癌专家会诊。
参考资料
[1]Wu Z,et al. Glycan shielding enables TCR-sufficient allogeneic CAR-T therapy[J]. Cell, 2025.
https://www.cell.com/cell/fulltext/S0092-8674(25)00910-9
[2]Fang J,et al. αPD-1-mesoCAR-T cells partially inhibit the growth of advanced/refractory ovarian cancer in a patient along with daily apatinib[J]. Journal for immunotherapy of cancer, 2021, 9(2): e001162.
https://jitc.bmj.com/content/9/2/e001162
[3]Zhang C,et al.Phase I escalating-dose trial of CAR-T therapy targeting CEA+ metastatic colorectal cancers[J]. Molecular Therapy, 2017, 25(5): 1248-1258.
https://www.cell.com/molecular-therapy-family/molecular-therapy/fulltext/S1525-0016(17)30108-9?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS1525001617301089%3Fshowall%3Dtrue
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐

4个月婴儿确诊致命脑瘤被判死刑,革命性抗
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

胰腺癌实现完全缓解!2026癌症疫苗,T
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
22款肺癌新药扎堆上市!2026这些基因
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
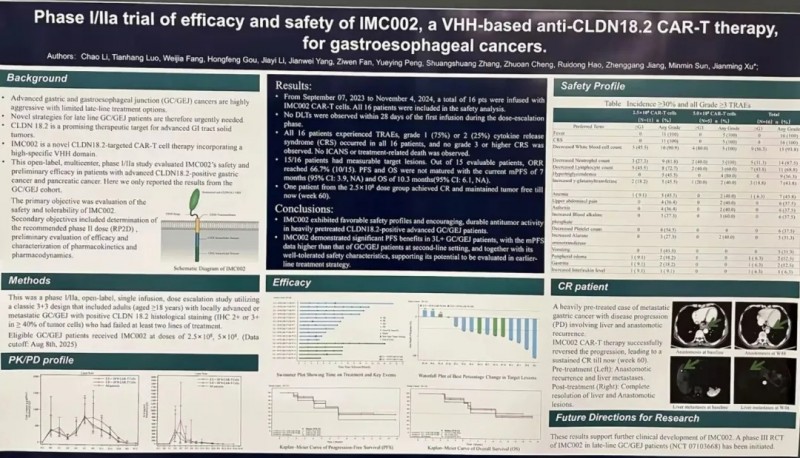
66.7%显著缩小 + 60周持续完全缓
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
"打一针"实现长期生
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

国研双抗突破实体瘤困局!首次人体研究结果
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05









![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




