全球首款双功能新药中国获批上市!另附2026胃癌救命清单速藏:12款获批药+五大新技术
2026年1月7日瑞拉芙普α注射液(艾泽利、SHR-1701)获批上市,另附2026年肺癌新药新技术
在中国,胃癌堪称最令人忌惮的恶性肿瘤之一,全球近半数的新发胃癌病例与死亡病例都集中在我国。而在2026年1月7日新年伊始,胃癌治疗领域传来重磅喜讯——瑞拉芙普α注射液(研发代号SHR-1701,商品名:艾泽利®)获中国国家药品监督管理局批准上市,与氟尿嘧啶类和铂类药物联合,用于经规范检测确诊为PD-L1阳性(CPS≥1)的局部晚期不可切除、复发或转移性胃及胃食管结合部腺癌的一线治疗,作为全球首款获批的PD-L1/TGF-βR Ⅱ双特异性抗体融合蛋白类创新药,为患者带来突破性治疗新选择。
值得一提的是,除了这款全新获批的重磅新药,2025年中美两国已有多款胃癌治疗新药陆续获批上市。这一系列突破性进展,将为更多胃癌患者带来全新治疗方案,重燃战胜病魔的希望。为此,医学部特别整理了《2026胃癌抗癌速查清单》,清单涵盖治疗方案梳理、2025年获批新药解读、2026年待上市新药与新技术前瞻,以及康复指导等核心内容,愿为你2026年的抗癌之路照亮前行方向,建议收藏备用。
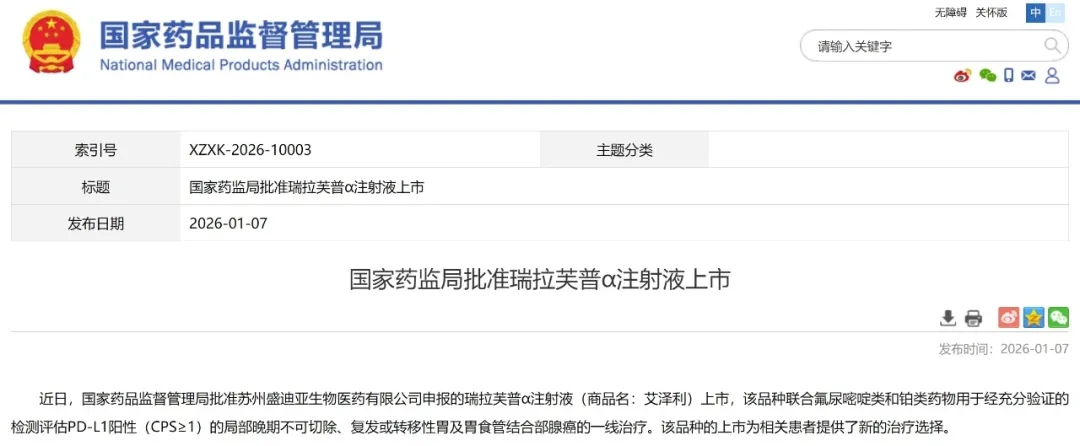
▲截图源自“NMPA”
国产创新药SHR-1701问鼎全球首款!胃癌生存期延长超6个月
瑞拉芙普-α注射液(即SHR-1701)是恒瑞医药自主研发的一款抗PD-L1/TGF-βRII双功能融合蛋白。其结构由靶向PD-L1的IgG4单克隆抗体与TGF-β ⅡR胞外域融合而成,既能促进效应性T细胞活化,又能有效改善肿瘤微环境的免疫调节状态,最终增强免疫系统对肿瘤细胞的杀伤能力。随着2026年1月7日获批上市,该药也成为了全球首款获批的PD-L1/TGF-βR Ⅱ双特异性抗体融合蛋白类创新药,此前国内外尚无同类产品获批上市。
本次获批主要基于一项Ⅲ期临床研究(SHR-1701-Ⅲ-307,NCT04950322)的振奋数据。该研究共纳入731例患者,被随机分配至SHR-1701联合化疗组(365例)、安慰剂联合化疗组(366例),截至2024年5月20日,中位随访时间达8.5个月(四分位间距5.6-13.2个月)。
结果显示:在意向性治疗(ITT)人群中,SHR-1701联合化疗组的中位总生存期(OS)达15.8个月,显著优于安慰剂联合化疗组的11.2个月[HR=0.66(95%CI:0.53–0.81,p<0.0001,详见下图];同时,该治疗组的无进展生存期(PFS)、客观缓解率(ORR)及缓解持续时间(DoR)均优于对照组(详见下表)。
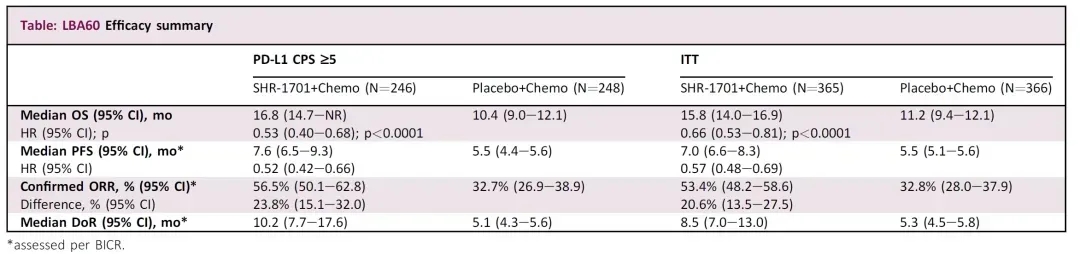
▲数据源自“Annals of Oncology”
在PD-L1 CPS≥5的患者亚组中,获益优势更为突出:SHR-1701联合化疗组中位总生存期延长至16.8个月,远超安慰剂联合化疗组的10.4个月[HR=0.53(95%CI:0.40-0.68),p<0.0001,详见下图]。
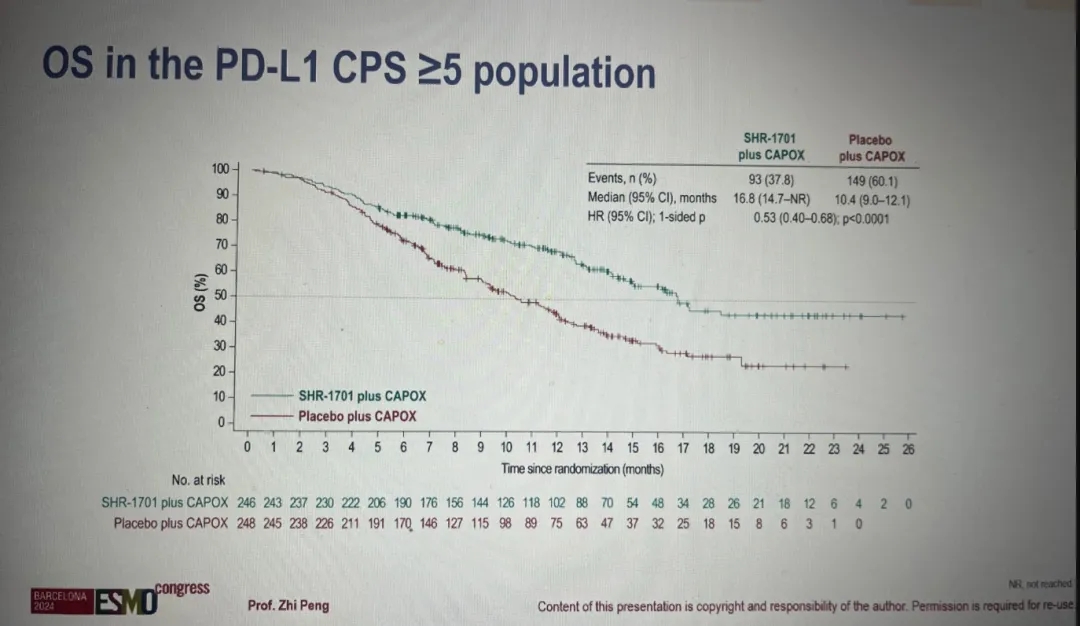
▲图源“ESMO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
2025年最新获批的胃癌靶向、免疫药物
对胃癌患者而言,这是一个满载奇迹的时代!2025年,中国NMPA及美国FDA已最新批准2款胃癌靶向与免疫药物,为无数病友带来全新治疗选择与生存希望!
帕博利珠单抗
1、药品简介
①药物名称:帕博利珠单抗(派姆单抗,Pembrolizumab,Keytruda®)。
②研发公司:默沙东(MSD)。
③治疗靶点:PD-L1。
④适应证:局部晚期不可切除或转移性HER2阳性胃腺癌/胃食管连接部(GEJ)腺癌。
⑤获批时间:2025年3月19日(胃癌)。
2、药物详情
帕博利珠单抗是默沙东(MSD)研发的一款重磅抗PD-1抑制剂,其作用机制为阻断PD-1与PD-L1、PD-L2的相互作用,激活T淋巴细胞,通过增强人体自身免疫系统的能力识别并对抗肿瘤细胞,同时该药也是中国首个获批上市的PD-1抑制剂。
2025年3月19日,FDA批准帕博利珠单抗联合曲妥珠单抗、含氟嘧啶及铂类化疗的方案,用于一线治疗肿瘤表达PD-L1(CPS≥1)的成人局部晚期不可切除或转移性HER2阳性胃腺癌/胃食管连接部(GEJ)腺癌。
度伐利尤单抗
1、药品简介
①药物名称:度伐利尤单抗(Durvalumab,英飞凡®,Imfinzi®)。
②研发公司:阿斯利康。
③治疗靶点:PD-L1。
④适应证:胃或胃食管交界处腺癌。
⑤获批时间:2025年11月25日。
2、药物详情
度伐利尤单抗是阿斯利康自主研发的程序性死亡配体1(PD-L1)抑制剂。2025年11月25日,美国FDA正式批准该药物联合FLOT化疗方案(氟尿嘧啶+亚叶酸钙+奥沙利铂+多西他赛),后续序贯度伐利尤单抗单药治疗的全周期方案,用于成人可切除胃腺癌或胃食管交界处腺癌(GC/GEJC)的新辅助与辅助治疗。
2026即将上市的结直肠癌新药
多款火遍癌友圈的明星药物与新技术,凭借显著疗效斩获突破性治疗认定及优先审批,其中部分将于2026年上市,值得胃癌病友满心期待!
安尼妥单抗
1、药品简介
①药物名称:安尼妥单抗(KN026)。
②研发公司:石药集团/康宁杰瑞。
③适应证:胃癌。
④预计上市时间:2026年Q3。
2、药物详情
安尼妥单抗(KN026)是康宁杰瑞自主研发的一款新型HER2靶向双特异性抗体,可同时结合HER2的两个非重叠表位,实现对HER2信号通路的强效阻断。
2025年9月12日,该药的上市申请获CDE受理,并被纳入优先审评通道,联合化疗用于至少接受过一种系统性治疗失败的HER2阳性局部晚期、复发或转移性胃/胃食管结合部腺癌。据悉它是首个申报上市的国产HER2双抗,预计2026年第三季度(Q3)获批。
舒瑞基奥仑赛
1、药品简介
①药物名称:舒瑞基奥仑赛注射液(satricabtagene autoleucel,简称“satri-cel”)。
②研发公司:科济药业。
③适应证:胃癌。
④预计上市时间:2026年Q2。
2、药物详情
舒瑞基奥仑赛注射液(satri-cel)是科济药业研发的自体CAR-T细胞疗法,靶向肿瘤相关蛋白Claudin18.2,拟用于治疗Claudin18.2阳性实体肿瘤。
2025年6月26日,该药的上市申请正式获国家药品监督管理局受理,拟适应症为Claudin18.2表达阳性、至少二线治疗失败的晚期胃/食管胃结合部腺癌患者。该申请已被纳入优先审评通道,凭借突破性的临床数据,预计2026年第二季度(Q2)在中国获批。
胃癌已获批上市的12款靶向/免疫治疗方案大全
截至2025年12月,中国、美国共批准了12款靶向及免疫治疗药物,用于胃癌的治疗(详见下表)。
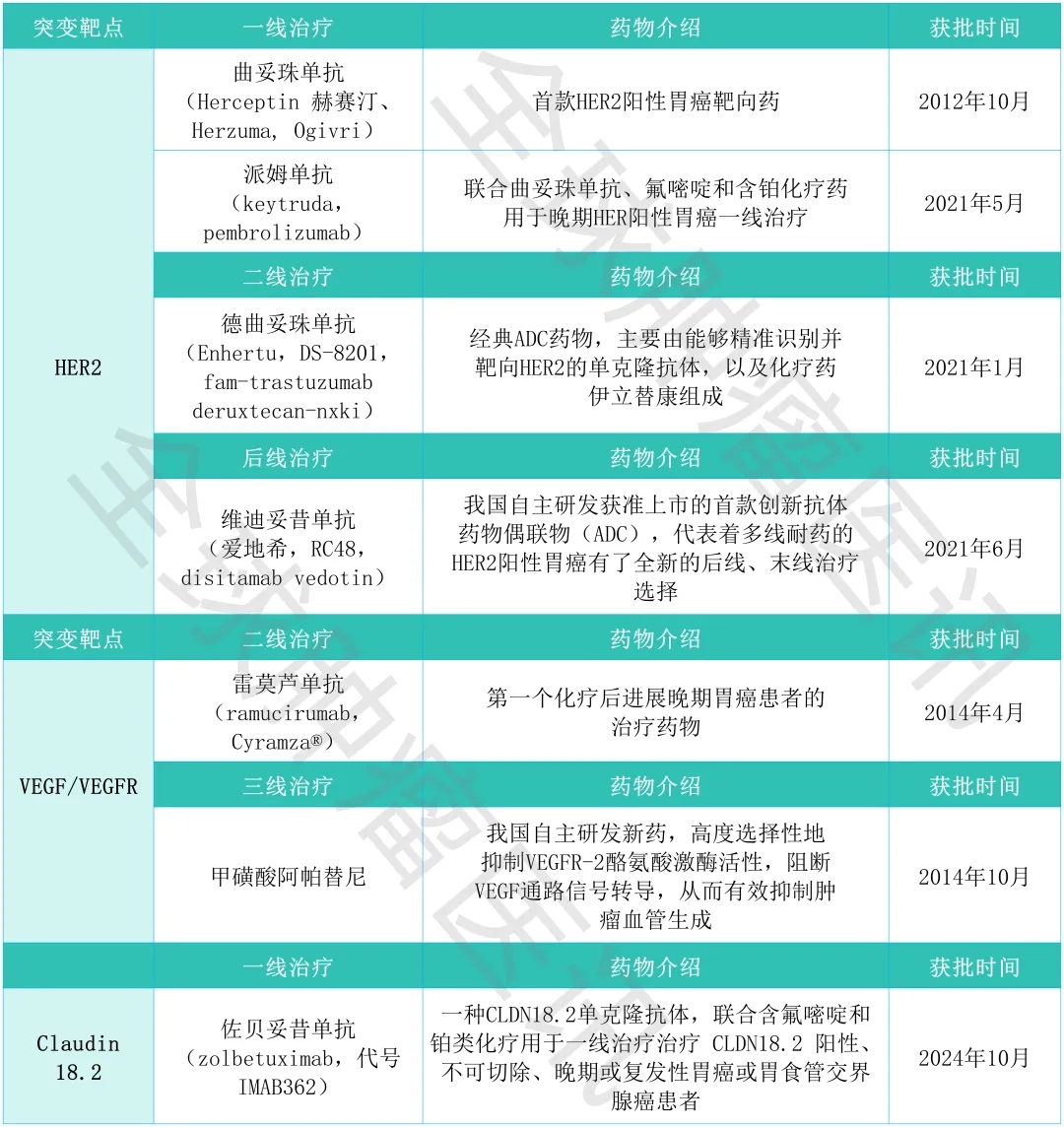

2026年胃癌值得关注的五大新技术
胃癌已进入“精准诊疗”与“全程管理”时代,治疗不再“一刀切”,而是基于基因分型、病理特征和患者整体状况的个体化战争。
舒瑞基奥仑赛:全球首款靶向Claudin18.2的CAR-T疗法有望上市
舒瑞基奥仑赛注射液(satri-cel)是科济药业研发的自体CAR-T细胞疗法,靶向肿瘤相关蛋白Claudin18.2。该药上市申请于2025年6月26日获国家药品监督管理局受理,预计2026年第二季度(Q2)在中国获批。若进展顺利,它将成为全球首款针对实体瘤的CAR-T产品。
其关键随机2期对照试验(CT041-ST-01)数据于2025年ASCO年会公布,satri-cel治疗组相较标准治疗组(TPC)核心疗效指标优势显著:satri-cel组确诊客观缓解率(ORR)为22%(23/104,95%CI:15–31),疾病控制率(DCR)达63%(95%CI:52–72)。中位无进展生存期(PFS)达3.25个月(95%CI:2.86–4.53),远超TPC组的1.77个月(95%CI:1.61–2.04,详见下图A);中位总生存期(OS)为7.92个月(95%CI:5.78–10.02),较TPC组的5.49个月(95%CI:3.94–6.93)提升超30%。
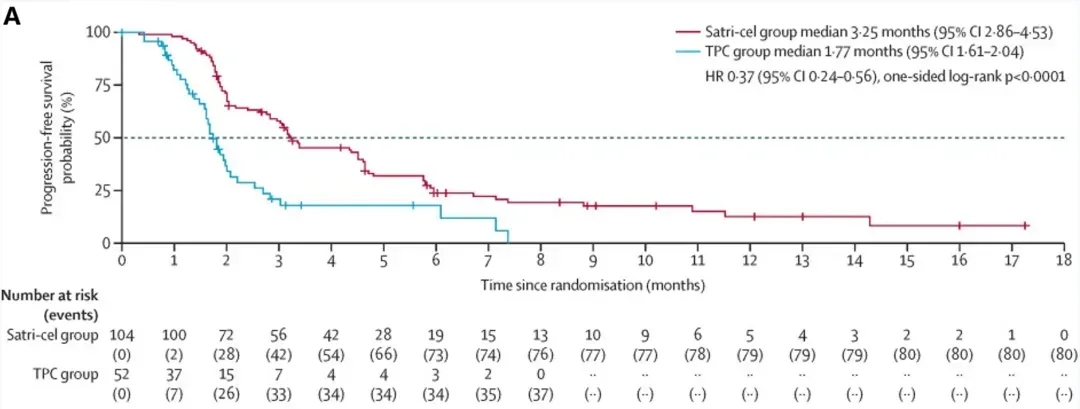
▲图源“The Lancet”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
值得一提的是,研究中的一则典型案例展现了独特的治疗响应过程:患者输注satri-cel后第2周肝脏病灶较基线增大,后续持续随访中病灶逐步缩小,至输注后第26周已显著小于基线水平(详见下图)。
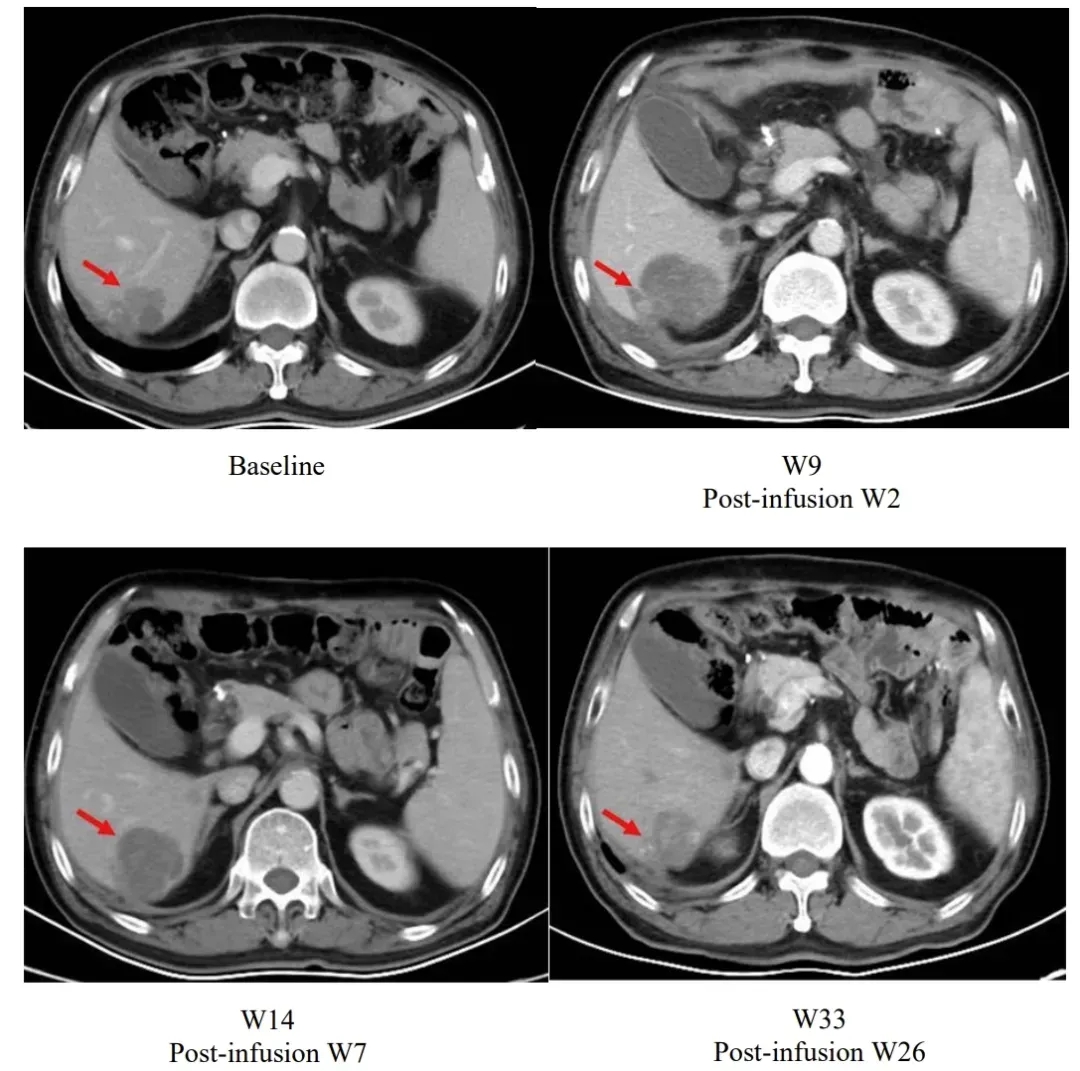
▲图源“The Lancet”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
全球首例!NK细胞联合方案,让晚期胃印戒细胞癌患者近4年无复发
《Medicine(Baltimore)》首次报道一则突破性案例:晚期胃印戒细胞癌患者采用手术+化疗+NK细胞辅助治疗联合方案后,实现长达46个月无复发的显著疗效,为这一难治癌种的治疗带来全新希望。
该案例患者为41岁女性,因阵发性呕吐病史一年余就诊,胃镜检查确诊胃印戒细胞癌。患者接受根治性R0胃切除术后,病理报告确诊为胃窦小弯溃疡性低分化腺癌(以印戒细胞癌为主,少量黏液腺癌);肿瘤大小7×6×1.8cm,已侵犯胃壁全层,血管内见肿瘤血栓,胃大弯淋巴结部分转移,最终分期为IIIC期(T4a,N3a,M0)。2016年11月,患者开启同种异体NK细胞输注治疗,频率为每三个月一次。
令人振奋的是,NK细胞治疗后患者肿瘤标志物持续改善,多次随访(V4-V8)中CA72-4逐步恢复正常,腹部CT扫描亦未发现疾病进展迹象。截至最新随访,患者自首次NK细胞输注后已平稳度过46个月(约3.8年),无任何复发迹象,身体状况良好。
γδ T细胞:胃癌恶性腹水大幅消退
胃癌腹膜播散引发的恶性腹水,往往对化疗耐药且预后极差,而Vγ9Vδ2T细胞(γδ-T细胞的一种)的临床应用,为这类难治性患者带来全新转机。
近期一项针对“腹膜内输注体外扩增Vγ9Vδ2T细胞联合唑来膦酸治疗胃癌腹膜播散恶性腹水”的临床研究,验证了该疗法的可行性。
结果显示:2例可评估疗效的患者均获显著应答,临床症状大幅缓解:患者2328治疗后CT提示腹水大幅减少、近乎完全消失(详见下图B),因疗效突出追加两轮输注;患者2325的血性腹水转为清亮(详见下图C),CT同样显示腹水明显减少。
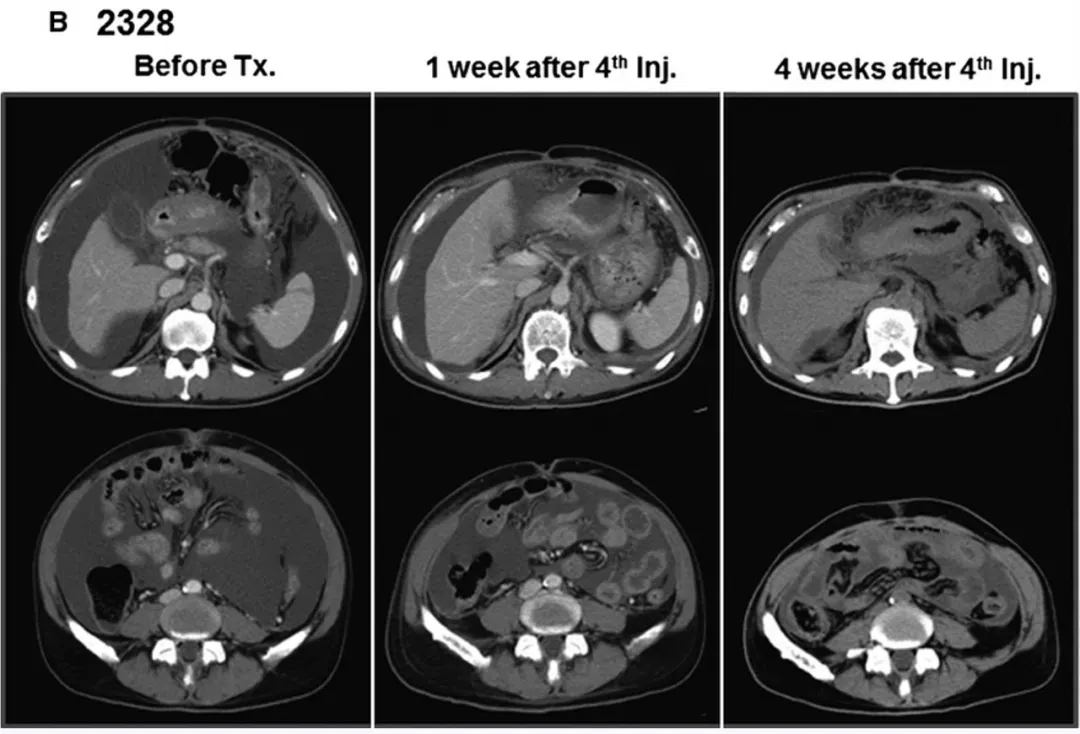

▲图源“WILEY Online Library”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
DC疫苗联合PD-1,实现晚期胃癌完全持久缓解
Neo-MoDC疫苗是我国自主研发的新抗原单核细胞衍生树突状细胞(DC)疫苗,其核心机制是激活机体免疫系统、促进T细胞富集,进而调动T细胞对全身癌细胞发起精准强效攻击。
《Nature》子刊报道了全球首个新抗原DC疫苗联合PD-1疗法实现晚期胃癌完全持久缓解的重磅案例!该患者确诊为IV期(BormannⅢ型)转移性胃癌,曾接受D2根治性远端胃切除术及FOLFOX方案化疗,后续仍发生腹膜与淋巴结转移。在临床无合适治疗方案时,患者入组接受Neo-MoDC疫苗联合PD-1抑制剂治疗。
结果振奋人心:联合治疗后患者肿瘤迅速缩小,最终病灶完全消失,且完全缓解状态已持续长达25个月。下图展示了该患者治疗前、治疗期间目标肿瘤病变的代表性图像。
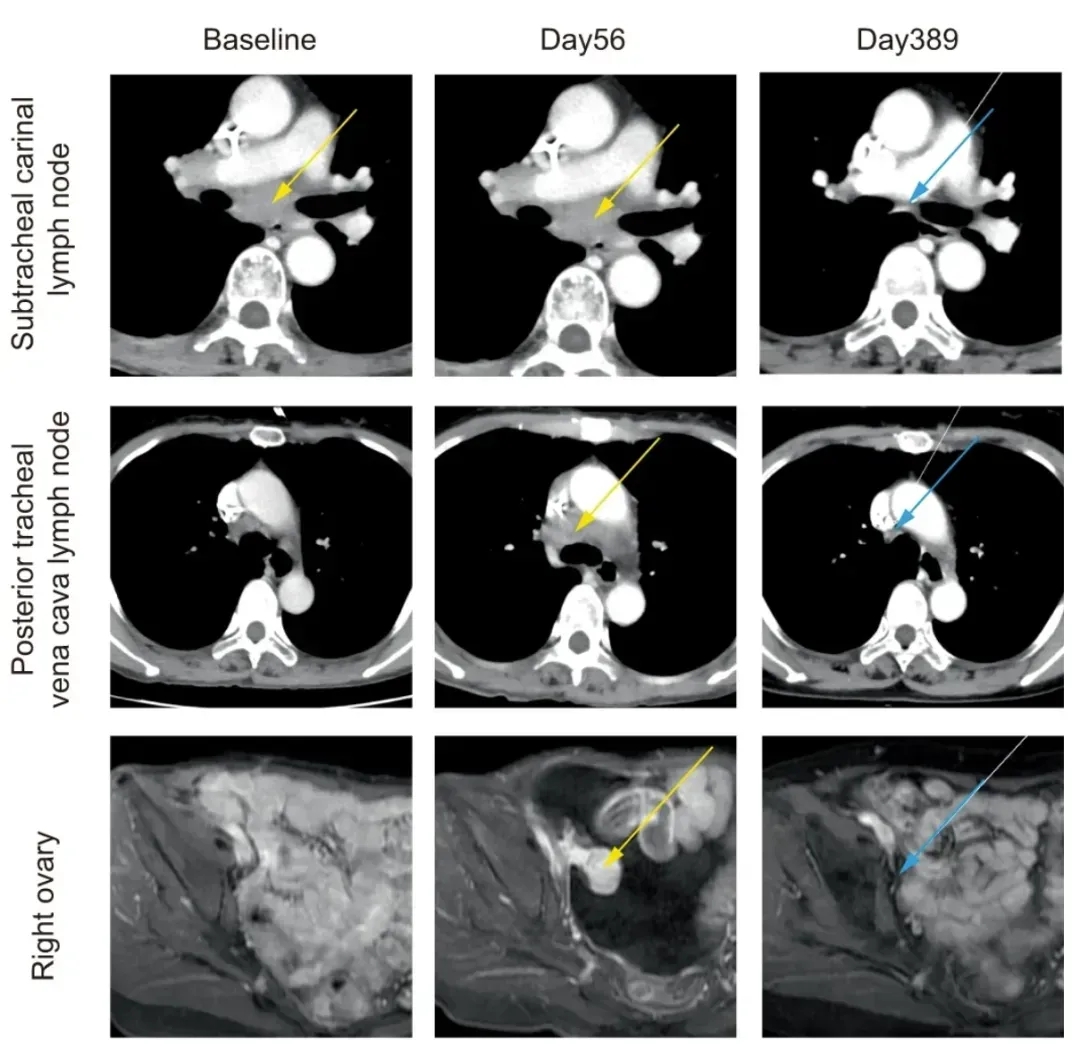
▲图源“WILEY Online Library”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
无创电场疗法进军胃癌一线:50% 患者病灶显著缩小或消失
近十年最具科幻色彩的抗癌黑科技,非电场疗法(TTFields)莫属。2022年6月3日,一项在中国开展的电场疗法联合化疗一线治疗胃腺癌的2期临床试验达成主要研究终点,结果振奋人心!
该研究纳入26例未接受过一线治疗的晚期胃癌患者,采用电场疗法联合化疗方案治疗后,确认客观缓解率达50%——这意味着半数患者的病灶缩小幅度超过30%,甚至完全消失。
2026胃癌患者:3大方向提升免疫,筑牢抗癌防线
胃癌患者本身免疫功能紊乱,而手术、放疗、化疗还会进一步损伤免疫—— 临床治疗后,快速调整免疫功能,是预防复发转移的关键!针对免疫低下或异常的患者,医生通常会建议胸腺肽类药物、干扰素注射,或细胞免疫回输等方式,助力恢复免疫识别与杀伤功能。具体可从三方面入手:
免疫调节剂:快速激活免疫基础
免疫调节剂属于非特异性免疫疗法,能助力免疫系统对抗癌细胞、细菌及病毒,包括胸腺肽、干扰素、白细胞介素等。临床中,放化疗后医生常会联合使用这类药物帮患者增强免疫,其中胸腺肽是最常用的免疫提升剂之一。
肠道菌群调节:解锁免疫“加速器”
越来越多研究证实,肠道菌群会影响化疗、靶向治疗、免疫治疗的疗效与安全性。其中,益生菌作为“有益活性微生物”,能有效提升免疫功能、降低放化疗副作用,部分菌株还可调节肠道菌群、增强抗肿瘤免疫反应,在预防肠道手术并发症方面也展现出巨大潜力。
首个评估益生菌对胃癌患者术后感染并发症与营养状况影响的荟萃研究,共纳入9项研究、861名患者。结果显示:补充益生菌可显著降低术后感染并发症发生率(RR0.46,95%CI 0.28,0.77);患者白蛋白水平得到显著改善(MD 0.73g/L;95%CI:0.01,1.46);可使住院时间显著缩短(MD-0.94天;95%CI:-1.33,-0.55);能缩短首次排气时间(MD-11.27小时;95%CI:-16.83,-5.70);还可缩短首次排便时间(MD-15.71小时;95%CI:-25.62,-5.79)。
综上,益生菌对改善胃癌术后患者预后、促进术后恢复、预防术后感染、提升营养状况均具有积极作用。
饮食调理:营养为免疫“充电”
治疗前后,肿瘤本身或放化疗、手术等会导致患者食欲下降、厌食,影响营养吸收与免疫力,进而降低治疗耐受度、增加复发风险。建议通过以下饮食原则补充营养:
1、高蛋白膳食:按每公斤理想体重供给 1.2~2.0g 蛋白质,改善肿瘤导致的营养不良;
2、高纤维膳食:每日膳食纤维摄入≥30g,可在普食基础上适当增加富含膳食纤维的食物;
3、补充维生素与微量元素:重点摄入维生素 A、C、D、E 及铁、锌等,维持体重稳定,满足抗癌营养需求。
小编寄语
胃癌患者确诊后或当前治疗效果不佳时,最关心的就是能否找到权威专家,获取更优诊疗方案以改善预后。令人欣慰的是,过去十年,胃癌治疗取得长足进步,显著延长了晚期患者的生存期。
除了已提及的治疗方式,还有更多新药正在研发中,更多病友有望通过新药进一步延长生存。让我们共同期待:更多新药早日上市、造福患者!更盼2026年,胃癌病友都能战胜病魔,续写一个又一个十年生存期!医学部专家也将为病友提供会诊或第二医疗意见,助力大家了解更多治疗方向、做出明智选择。
参考资料
[1]Peng Z,et al.LBA60 Phase III study of SHR-1701 versus placebo in combination with chemo as first-line (1L) therapy for HER2-negative gastric/gastroesophageal junction adenocarcinoma (G/GEJA)[J]. Annals of Oncology, 2024, 35: S1250.
https://www.annalsofoncology.org/article/S0923-7534(24)03882-1/fulltext
[2]Wada I,et al.Intraperitoneal injection of in vitro expanded Vγ9Vδ2 T cells together with zoledronate for the treatment of malignant ascites due to gastric cancer[J]. Cancer medicine, 2014, 3(2): 362-375.
onlinelibrary.wiley.com/doi/10.1002/cam4.196
[3]Guo Z,et al.Durable complete response to neoantigen-loaded dendritic-cell vaccine following anti-PD-1 therapy in metastatic gastric cancer.NPJ Precis Oncol.2022 Jun 3;6(1):34.
https://www.nature.com/articles/s41698-022-00279-3
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐

胰腺癌实现完全缓解!2026癌症疫苗,T
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
22款肺癌新药扎堆上市!2026这些基因
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
66.7%显著缩小 + 60周持续完全缓
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
"打一针"实现长期生
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

国研双抗突破实体瘤困局!首次人体研究结果
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
9cm巨大唾液腺肿瘤消失!新型靶向药改写
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05






![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




