2025医保初审传捷报:百款抗癌新药入围,CAR-T、ADC等高价药有望降价,惠及万千患者
2025医保初审传捷报:百款抗癌新药入围医保目录,CAR-T、ADC等高价药有望降价,惠及万千患者
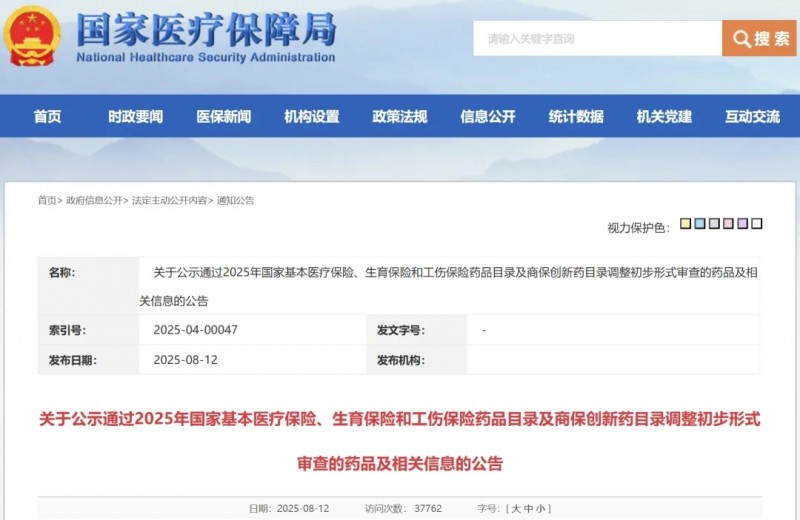
一款好药,唯有让患者用得起,才能真正体现其价值。2025年8月12日,国家医保局公示了《通过2025年国家基本医疗保险、生育保险和工伤保险药品目录及商保创新药目录调整初步形式审查的申报药品名单》。经初步审核,共有534个药品通过形式审查,其中目录外通过初审的通用名达310个,较2024年的249个有明显增加。
值得关注的是,今年目录调整新增商保创新药目录,与基本医保目录同步申报,本次公示时间为8月12日至8月18日。此次初步审查目录涵盖多款CAR-T产品以及ADC药物、双抗类药物等抗癌新药,若能顺利通过后续审查,这些药品的治疗费用将大幅降低,从“天价”变为“平价”,真正“飞入寻常百姓家”。
小编已第一时间更新了这份目录的解读,不妨看看有没有你需要的抗癌药上榜,建议先收藏以备不时之需。
《2025医保初审目录》要点解读
根据国家医保局发布的文件,本次基本医保目录调整的初步审核结果显示,共有534个药品通过形式审查。其中,目录外通过初审的通用名达310个,较2024年的249个有明显增加。
值得注意的是,今年目录调整新增了商保创新药目录,与基本医保目录同步申报,经初步审核,121个药品通用名通过形式审查。其中,79款药品同时通过了基本目录和商保目录的形式审查,涵盖12款单抗、3款CAR-T疗法、1款ADC、1款双抗、2款中成药等。
在CAR-T产品方面,国内目前已获批上市的7款产品中,有5款申报了商保创新药目录,仅2025年7月29日上市的雷尼基奥仑赛(恒润达生)、2024年8月20日上市的西达基奥仑赛(传奇生物)未参与本次商保谈判。
回到基本医保目录,其申报阶段共收到718份信息,涉及633个药品通用名,最终534个通过形式审查(目录外申报472份,涉及393个通用名,310个通过初审)。值得关注的是,通过初审的目录外品种中包含多款独家抗癌新药,其中19款为今年上半年首次在国内获批的抗肿瘤新药,涵盖ADC药物、CAR-T产品、小分子抑制剂、CD38单抗、CD3/CD19双抗类药物等多种类型,适应症包括非小细胞肺癌、乳腺癌、宫颈癌、卵巢癌、结直肠癌、肝癌、头颈部肿瘤、前列腺癌、多发性骨髓瘤、淋巴瘤、白血病等多个癌种(详见下表)。
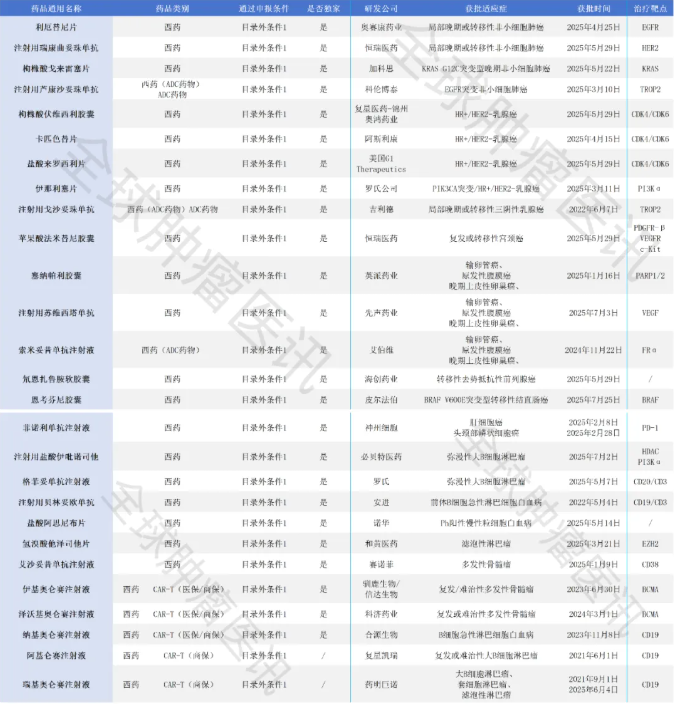
2025年医保初审目录中在中国获批的抗肿瘤新药
2025年医保初审目录中,不乏具有“首个”意义的突破性重磅药物,下面小编针对24款主要的抗癌新药,为大家展开详细介绍。
利厄替尼片
药品简介
①药物名称:利厄替尼片(奥壹新®,研发代号ASK120067)。
②研发公司:江苏奥赛康药业。
③治疗靶点:EGFR。
④适应证:局部晚期或转移性非小细胞肺癌。
⑤获批时间:2025年4月25日。
药物详情
利厄替尼是一款具有全新分子结构的第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),2025年4月25日,该药的新适应症上市申请在中国获批,用于具有EGFR外显子19缺失(19DEL)或外显子21置换突变(L858R)的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗。
关键IIB期临床研究数据显示:客观缓解率(ORR)高达68.8%,中位缓解持续时间(DoR)为11.1个月,中位无进展生存期(PFS)为11.0个月,疾病控制率(DCR)达到92.4%,这意味着绝大多数患者的病情得到有效控制。
注射用瑞康曲妥珠单抗
药品简介
①药物名称:瑞康曲妥珠单抗(商品名:艾维达®)。
②研发公司:恒瑞医药。
③治疗靶点:HER2。
④适应证:局部晚期或转移性非小细胞肺癌。
⑤获批时间:2025年5月29日。
药物详情
瑞康曲妥珠单抗是一款靶向HER2的抗体偶联药物(ADC),由曲妥珠单抗、可裂解连接子及拓扑异构酶I抑制剂有效载荷SHR169265巧妙组合而成。2025年5月29日,该药获得国家药监局批准,单药用于成人存在HER2(ERBB2)激活突变且既往接受过至少一种系统治疗的不可切除的局部晚期或转移性非小细胞肺癌的治疗。
1/2期SHR-A1811-I-103临床研究数据显示,全剂量组经研究者评估确认的客观缓解率(ORR)为38.1%,疾病控制率(DCR)为90.5%,中位无进展生存期(PFS)为9.5个月,中位反应持续时间(DOR)为10.3个月。
枸橼酸戈来雷塞片
药品简介
①药物名称:戈来雷塞片(glecirasib,JAB-21822,艾瑞凯®)。
②研发公司:加科思。
③治疗靶点:KRAS。
④适应证:KRAS G12C突变型晚期非小细胞肺癌。
⑤获批时间:2025年5月22日。
药物详情
戈来雷塞片是加科思自主研发的一款KRAS G12C抑制剂。2025年5月22日,获中国国家药品监督管理局药品审评中心(NMPA)批准,单药治疗至少接受过一种系统性治疗的KRAS G12C突变型晚期非小细胞肺癌(NSCLC)成人患者。
2024 ASCO大会公布的Ⅱ期注册性临床试验数据显示,在单药二线治疗的非小细胞肺癌患者中,经确认的客观缓解率(ORR)达47.9%(56/117)。其中,4例患者实现肿瘤靶病灶完全消失(完全缓解,CR),36例患者肿瘤缩小超过50%;疾病控制率(DCR)为86.3%。中位无进展生存期(mPFS)为8.2个月,中位总生存期(mOS)为13.6个月。
注射用芦康沙妥珠单抗
药品简介
①药物名称:芦康沙妥珠单抗(SKB264、Sac-TMT、佳泰莱®)。
②研发公司:四川科伦博泰。
③治疗靶点:TROP2。
④适应证:EGFR突变非小细胞肺癌。
⑤获批时间:2025年3月10日。
药物详情
芦康沙妥珠单抗是由中国科伦博泰生物享誉国际的ADC研发平台—OptiDC研发的具有代表性的靶向TROP2的创新ADC药物。
2025年3月10日,在中国获批上市,用于治疗经表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)和含铂化疗治疗失败的局部晚期或转移性EGFR突变非小细胞肺癌(NSCLC)成人患者。
枸橼酸伏维西利胶囊
药品简介
①药物名称:枸橼酸伏维西利胶囊(复妥宁®)。
②研发公司:复星医药控股子公司锦州奥鸿药业。
③治疗靶点:CDK4/6。
④适应证:HR阳性、HER2阴性乳腺癌。
⑤获批时间:2025年5月29日。
药物详情
枸橼酸伏维西利胶囊是一款创新型小分子CDK4/6抑制剂,通过抑制细胞周期进程,阻断细胞从G1期向S期过渡,从而有效减缓癌细胞的增殖速度,还可诱导肿瘤细胞凋亡,达到控制肿瘤发展的目的。
2025年5月29日,该药获得国家药监局批准上市,用于成人既往接受内分泌治疗后出现疾病进展的激素受体(HR)阳性、人表皮生长因子2(HER2)阴性的复发或转移性乳腺癌的治疗。
II期临床研究(NCT05004142)数据显示:客观缓解率(ORR)为40.9%,12个月无进展生存(PFS)率为67.7%,12个月总生存(OS)率更是高达95.9%。
卡匹色替片
药品简介
①药物名称:卡匹色替片(Capivasertib,Truqap)。
②研发公司:阿斯利康。
③治疗靶点:CDK4/CDK6。
④适应证:HR阳性、HER2阴性的转移性/局部晚期乳腺癌。
⑤获批时间:2025年4月15日。
药物详情
卡匹色替是国内首个获批的AKT抑制剂。2025年4月15日,中国国家药品监督管理局批准卡匹色替片联合氟维司群,用于转移性阶段至少接受过一种内分泌治疗后疾病进展,或在辅助治疗期间或完成辅助治疗后 12 个月内复发的激素受体(HR)阳性、人表皮生长因子受体 2(HER2)阴性且伴有一种或多种 PIK3CA/AKT1/PTEN 改变的局部晚期或转移性乳腺癌成人患者。此前,该药已在美国、欧盟、日本等相继获批。
盐酸来罗西利片
药品简介
①药物名称:盐酸来罗西利片(凯丽隆®,英文通用名:Letrozole)。
②研发公司:美国G1 Therapeutics公司。
③治疗靶点:CDK4/6。
④适应证:HR+/HER2-局部晚期或转移性乳腺癌。
⑤获批时间:2025年5月29日。
药物详情
盐酸来罗西利片是一种口服细胞周期蛋白依赖性激酶(CDK4/6)抑制剂,2025年5月29日,中国NMPA批准盐酸来罗西利片的上市申请,用于成人HR阳性、HER2阴性(HR+/HER2-)局部晚期或转移性乳腺癌的治疗。
在多中心Ⅲ 期 MONARCH 临床试验中,盐酸来罗西利片联合内分泌治疗展现出显著疗效:与单纯内分泌治疗相比,联合治疗可将患者的中位无进展生存期(PFS)延长近一倍,其中盐酸来罗西利片联合阿那曲唑的中位 PFS 达 28.2 个月,而阿那曲唑单药组为 14.8 个月;同时,联合治疗能使更多患者的肿瘤缩小或稳定,部分患者甚至达到完全缓解。
伊那利塞片
药品简介
①药物名称:伊那利塞片(Inavolisib,Itovebi,GDC-0077)。
②研发公司:罗氏公司。
③治疗靶点:PI3Kα。
④适应证:PIK3CA突变、HR阳性、HER2阴性乳腺癌。
⑤获批时间:2025年3月11日。
药物详情
伊那利塞片是中国首个获批的第三代高选择性PI3Kα抑制剂,同时也是首个获得中美双重突破性疗法认证的HR+乳腺癌治疗产品。
2025年3月11日,中国国家药品监督管理局(NMPA)批准了该药的上市申请,与哌柏西利+氟维司群联合,用于成人内分泌治疗耐药(包括在辅助内分泌治疗期间或之后出现复发)、PIK3CA突变、HR(激素受体)阳性、HER2(人表皮生长因子受体2)阴性的局部晚期或转移性乳腺癌的治疗。
该药本次获批主要基于III期INAVO120临床研究(NCT04191499)数据:其治疗组客观缓解率(ORR)达58.4%,较安慰剂组(25.0%)显著提升33.4个百分点;同时中位无进展生存期(PFS)延长近一倍,从安慰剂组的7.3个月提升至15.0个月。
苹果酸法米替尼胶囊
药品简介
①药物名称:苹果酸法米替尼胶囊。
②研发公司:恒瑞医药。
③治疗靶点:PDGFR-β、VEGFR、c-Kit。
④适应证:复发或转移性宫颈癌。
⑤获批时间:2025年5月29日。
药物详情
苹果酸法米替尼胶囊一款小分子酪氨酸激酶抑制剂(TKI),可靶向PDGFR-β、VEGFR和c-Kit等多个靶点。2025年5月29日,该药的上市申请获国家药监局批准,与卡瑞利珠单抗联合,用于既往接受含铂化疗治疗失败但未接受过贝伐珠单抗治疗的复发或转移性宫颈癌患者。
该药此次获批主要基于一项II 期临床研究(SHR-1210-II-217)数据。结果显示:客观缓解率(ORR)达44.6%,中位无进展生存期(mPFS)为6.4个月,中位总生存期(mOS)达到 20.2 个月,展现出显著的生存获益。
塞纳帕利胶囊
药品简介
①药物名称:塞纳帕利胶囊。
②研发公司:英派药业。
③治疗靶点:PARP1/2。
④适应证:晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌(维持治疗)。
⑤获批时间:2025年1月16日。
药物详情
塞纳帕利是由英派药业自主研发的一款新型、高效的PARP1/2抑制剂,具有独特的分子结构,使其具备体外和体内高活性,以及高靶向选择性和广泛的安全窗口。2025年1月16日,获中国NMPA批准上市,用于晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者在一线含铂化疗达到完全缓解或部分缓解后的维持治疗。
塞纳帕利的获批主要基于Ⅲ期FLAMES临床研究(NCT04169997)的积极结果:数据显示塞纳帕利维持治疗可显著延长晚期卵巢癌患者的中位无进展生存期(mPFS),分别为未达到(塞纳帕利组) vs 13.6个月(安慰剂组),风险比(HR)为0.43(P<0.0001),这意味着塞纳帕利组患者的疾病进展或死亡风险降低了57%。
注射用苏维西塔单抗
药品简介
①药物名称:苏维西塔单抗(suvemcitug)。
②研发公司:先声药业。
③治疗靶点:VEGF。
④适应证:含铂化疗治疗失败的复发性卵巢癌、输卵管癌或原发性腹膜癌。
⑤获批时间:2025年7月3日。
药物详情
苏维西塔单抗(suvemcitug)属于新一代重组人源化抗VEGF兔源单克隆抗体,它能高度选择性地与人体VEGF相结合,阻断VEGF的生物活性,从根源上减少肿瘤血管生成,进而抑制肿瘤的生长。
2025年7月3日,该药获中国国家药品监督管理局批准上市,与紫杉醇、多柔比星脂质体或拓扑替康联合,用于铂耐药后接受过不超过1种系统治疗的成人复发性卵巢癌、输卵管癌或原发性腹膜癌的治疗。
2024 ASCO大会上公布了Ⅲ期SCORES临床试验(NCT04908787)数据证实苏维西塔单抗对含铂化疗失败的复发性卵巢癌等疗效显著。结果显示:苏维西塔单抗组中位无进展生存期(PFS)达5.49个月,显著长于安慰剂组的2.73个月(HR=0.46,P<0.0001)。
氘恩扎鲁胺软胶囊
药品简介
①药物名称:氘恩扎鲁胺软胶囊(海纳安®,曾用名:HC-1119软胶囊)。
②研发公司:海创药业。
③治疗靶点:/
④适应证:转移性去势抵抗性前列腺癌。
⑤获批时间:2025年5月29日。
药物详情
氘恩扎鲁胺软胶囊属于第二代雄激素受体(AR)抑制剂,2025年5月29日,获中国中国国家药品监督管理局(NMPA)批准上市,用于成人接受醋酸阿比特龙及化疗后出现疾病进展,且既往未接受新型雄激素受体抑制剂的转移性去势抵抗性前列腺癌(mCRPC)的治疗,该药也成为了国内首款获批上市治疗该适应症的国产创新药物。
2023年美国临床肿瘤学会(ASCO)年会上,公布了氘恩扎鲁胺(HC-1119)Ⅲ期临床研究的惊艳数据,与对照组相比,氘恩扎鲁胺显著延长了患者无进展生存期(PFS),将疾病进展或死亡风险降低了42%(HR=0.58,95% CI:0.439-0.770;p=0.0001)。氘恩扎鲁胺的HC-1119-04注册研究也纳入了2023版CSCO前列腺癌诊疗指南。
恩考芬尼胶囊
药品简介
①药物名称:恩考芬尼胶囊(毕太维®、BRAFTOVI)。
②研发公司:皮尔法伯(Pierre Fabre)。
③治疗靶点:BRAF。
④适应证:BRAF V600E突变型转移性结直肠癌。
⑤获批时间:2025年7月25日。
药物详情
2025年7月25日,恩考芬尼胶囊(商品名:毕太维、BRAFTOVI)和西妥昔单抗的联合疗法,获得中国国家药品监督管理局批准,用于既往接受过系统治疗的 BRAF V600E突变型转移性结直肠癌(mCRC)成人患者。
此次在中国获批主要基于关键性 III 期 BEACON CRC 试验研究的振奋数据。结果显示:该联合方案显著改善了患者的总体生存期,使死亡风险降低了 40%。
菲诺利单抗注射液
药品简介
①药物名称:菲诺利单抗注射液(Finotonlimab,SCT-I10A,安佑平®)。
②研发公司:神州细胞。
③治疗靶点:PD-1。
④适应证:头颈部鳞状细胞癌、肝细胞癌。
⑤获批时间:2025年2月8日、2025年2月28日。
药物详情
菲诺利单抗注射液是神州细胞自主研发的一款重组人源化抗PD-1 IgG4型单克隆抗体注射液,同时也是头颈部鳞癌首个国产PD-1药物。
2025年2月8日,该药获中国NMPA批准,与含铂化疗联合用于复发性和/或转移性头颈部鳞状细胞癌的一线治疗。同年2月28日再度获批,与贝伐珠单抗注射液(SCT510)的联合疗法获批,用于既往未接受过系统治疗的不可切除或转移性肝细胞癌治疗,与对照组相比,菲诺利单抗与贝伐珠单抗联合治疗组将客观缓解率从4%提高至33%,中位总生存期(OS)从14.2个月提高至22.1个月,死亡风险降低40%。
注射用盐酸伊吡诺司他
药品简介
①药物名称:注射用盐酸伊吡诺司他(贝特琳®,研发代号BEBT-908)。
②研发公司:必贝特医药。
③治疗靶点:HDAC/PI3Kα。
④适应证:复发或难治性弥漫性大B细胞淋巴瘤(r/r DLBCL)。
⑤获批时间:2025年7月2日。
药物详情
注射用盐酸伊吡诺司他是必贝特医药自主研发的全球首创(First-in-Class)HDAC/PI3Kα双靶点抑制剂,同时也是国内唯一自主研发获批用于治疗复发或难治性弥漫性大B细胞淋巴瘤(r/r DLBCL)的创新药。
2025年7月2日,获国家药品监督管理局(NMPA)正式批准上市,单药用于成人既往接受过至少两线系统性治疗的复发或难治性弥漫性大B细胞淋巴瘤(r/r DLBCL)。
Ⅱa期临床数据显示,在接受伊吡诺司他治疗后完成至少一次肿瘤评估的受试者中,三线及以上治疗r/r DLBCL的疾病控制率(DCR)达66.7%,客观缓解率(ORR)达50%。
格菲妥单抗注射液
药品简介
①药物名称:格菲妥单抗(glofitamab,Columvi®,高罗华®)。
②研发公司:罗氏。
③治疗靶点:CD20、CD3。
④适应证:弥漫大B细胞淋巴瘤。
⑤获批时间:2025年5月7日。
药物详情
格菲妥单抗是全球首个且目前唯一对R/R DLBCL患者进行固定周期治疗的双特异性抗体。
早在2023年11月,该药就已在中国获批,用于成人既往接受过至少两线系统性治疗的复发或难治性弥漫性大B细胞淋巴瘤(R/R DLBCL)的治疗。
2025年5月7日,新适应症获中国NMPA批准,与吉西他滨+奥沙利铂(GemOx)联合,用于不适合自体造血干细胞移植(ASCT)的复发或难治性弥漫大B细胞淋巴瘤非特指型(DLBCL NOS)成人患者(2L+ DLBCL)的治疗。
根据STARGLO研究结果,接受格菲妥单抗联合治疗的患者,中位总生存期几乎可以实现翻倍,中位OS达25.5个月(R-GemOx组12.9个月);中位无进展生存期(PFS)翻近四倍(13.8个月 vs 3.6个月),总缓解率和完全缓解率相比于对照组分别提高27.7%、33.2%。
盐酸阿思尼布片
药品简介
①药物名称:盐酸阿思尼布片(Asciminib,Scemblix®,信倍立®)。
②研发公司:诺华。
③治疗靶点:/
④适应证:Ph阳性慢性粒细胞白血病。
⑤获批时间:2025年5月14日。
药物详情
阿思尼布(asciminib)是全球首个且目前唯一基于ABL-STAMP(ABL肉豆蔻酰口袋)创新机制的慢性髓细胞白血病(CML)靶向治疗药物。2025年5月14日,其上市申请获中国国家药品监督管理局批准,适应症同为成人新诊断Ph+CML慢性期的治疗。
该药获批主要基于意向关键性III期ASC4FIRST临床试验(NCT04971226)的关键数据,结果显示:阿思尼布的MMR(主要分子反应)率明显优于标准治疗,48周时的MMR率分别为68%(阿思尼布组) vs 49%[酪氨酸激酶抑制剂(IS-TKI组)]。
氢溴酸他泽司他片
药品简介
①药物名称:他泽司他(Tazemetostat,Tazverik)。
②研发公司:和黄医药。
③治疗靶点:EZH2。
④适应证:滤泡性淋巴瘤(中国/美国)、晚期上皮样肉瘤(美国)。
⑤获批时间:2025年3月21日。
药物详情
他泽司他是一款口服的小分子EZH2抑制剂,同时也是全球首款获批上市的EZH2抑制剂!早在2020年1月,就曾获得美国FDA的加速批准,用于晚期上皮样肉瘤、复发/难治性滤泡性淋巴瘤的治疗。2025年3月21日,该药获中国国家药品监督管理局(NMPA)批准,用于成人EZH2突变阳性且既往接受过至少两种系统性治疗的复发或难治性滤泡性淋巴瘤(FL)的治疗。
艾沙妥昔单抗注射液
药品简介
①药物名称:艾沙妥昔单抗(Isatuximab,Sarclisa)。
②研发公司:赛诺菲(Sanofi)。
③治疗靶点:CD38。
④适应证:多发性骨髓瘤。
⑤获批时间:2025年1月9日。
药物详情
艾沙妥昔单抗(Isatuximab,Sarclisa)是一种抗CD38单克隆抗体,2025年1月9日,艾沙妥昔单抗获中国国家药品监督管理局(NMPA)批准,与泊马度胺和地塞米松联合,用于成人既往接受过至少一线治疗(包括来那度胺和蛋白酶体抑制剂)的多发性骨髓瘤的治疗。
伊基奥仑赛注射液
药品简介
①药物名称:伊基奥仑赛注射液(福可苏®,Equecabtagene Autoleucel Injection)。
②研发公司:驯鹿生物和信达生物。
③治疗靶点:BCMA。
④适应证:复发/难治性多发性骨髓瘤。
⑤获批时间:2023年6月30日。
药物详情
伊基奥仑赛注射液是一款全人源B细胞成熟抗原特异性CAR-T细胞,同时中国首款获批的BCMA CAR-T疗法,以及全球首款全人源BCMA靶向的CAR-T疗法!
2023年6月30日,获国家药品监督管理局(NMPA)批准上市,用于治疗复发/难治性多发性骨髓瘤(R/R MM)。1/2期临床研究数据显示,总体缓解率(ORR)竟高达96.0%!
泽沃基奥仑赛注射液
药品简介
①药物名称:泽沃基奥仑赛(zevor-cel,Zevorcabtagene Autoleucel,赛恺泽®,产品编号CT053)。
②研发公司:科济药业。
③治疗靶点:BCMA。
④适应证:复发或难治性多发性骨髓瘤。
⑤获批时间:2024年3月1日。
药物详情
泽沃基奥仑赛是一款靶向BCMA的自体CAR-T细胞产品,同时也是中国第五款CAR-T。2024年3月1日,新药上市申请获中国国家药品监督管理局(NMPA)批准,用于成年患者复发或难治性多发性骨髓瘤的治疗,这些患者既往接受过包括1种免疫调节剂、蛋白酶体抑制剂在内的至少3线治疗。
本次获批主要是基于一项中国LUMMICAR STUDY 1 Ⅰ/Ⅱ期临床试验(NCT03975907)的振奋数据。结果显示:所有患者的中位PFS长达25.0个月(14.9,不可评估[NE])。其中21.4%(3例)的患者达到部分缓解(PR);78.6%(11例)的患者达到完全缓解(CR)或严格完全缓解(sCR)。
纳基奥仑赛注射液
药品简介
①药物名称:纳基奥仑赛注射液(源瑞达®,CNCT19细胞注射液,Inaticabtagene Autoleucel Injection)。
②研发公司:合源生物。
③治疗靶点:CD19。
④适应证:B细胞急性淋巴细胞白血病。
⑤获批时间:2023年11月8日。
药物详情
纳基奥仑赛注射液是一款靶向CD19的CAR-T细胞治疗产品,同时也是中国首款治疗白血病的CAR-T细胞产品。
2023年11月8日在中国获批,用于治疗成人复发或难治性B细胞急性淋巴细胞白血病(r/r B-ALL),治疗3个月总体缓解率(ORR)高达82.1%!
阿基仑赛注射液
药品简介
①药物名称:阿基仑赛注射液(Axicabtagene Ciloleucel Injection,axi-cel,FKC876,奕凯达®)。
②研发公司:复发或难治性大B细胞淋巴瘤。
③治疗靶点:CD19。
④适应证:
⑤获批时间:2021年6月1日。研发公司:复星凯特。
药物详情
阿基仑赛注射液是一款CD19 CAR-T产品,同时也是中国首个以药品途径批准上市的CAR-T细胞治疗产品。2021年6月22日在中国获批上市,用于治疗成人复发或难治性大B细胞淋巴瘤(r/r LBCL)。
ZUMA-12的2期临床研究(NCT03761056),数据显示:ORR率达82%,12个月时预计OS率达91%(95% CI,73–97),12个月时的PFS率为75%(95% CI,55–87)。
瑞基奥仑赛注射液
药品简介
①药物名称:瑞基奥仑赛注射液(relma-cel,relmacabtagene autoleucel,倍诺达®,Carteyva®)
②研发公司:药明巨诺。
③治疗靶点:CD19。
④适应证:大B细胞淋巴瘤、套细胞淋巴瘤、滤泡性淋巴瘤。
⑤获批时间:2021年9月1日、2025年6月4日。
药物详情
瑞基奥仑赛注射液是中国首个获批用于治疗复发或难治性套细胞淋巴瘤(r/r MCL)的靶向CD19的CAR-T细胞治疗产品,同时也是国内首个拥有三项适应症的CAR-T疗法。
2021年9月1日在中国获批上市,用于治疗既往经过二线或以上系统性治疗后,复发或难治性大B细胞淋巴瘤。RELIANCE研究(NCT04089215)的4年随访结果显示:结果显示:3年总生存(OS)率为69.3%,4年总生存(OS)率为66.7%。
2025年6月4日,其新药上市许可申请(NDA)获中国澳门药物监督管理局批准,新增适应症包括:经二线或以上系统性治疗的成人复发或难治性大B细胞淋巴瘤(r/r LBCL);经二线或以上系统性治疗的成人难治性或24个月内复发的滤泡性淋巴瘤(r/r FL);经包括布鲁顿酪氨酸激酶抑制剂(BTKi)在内的二线及以上系统性治疗的成人复发或难治性套细胞淋巴瘤(r/r MCL)。
小编寄语
通常情况下,一种新药从申请到最终让中国患者用上,若为自费药,平均需5年时间;若再计入纳入医保目录的流程,则平均要等6~8年。不过值得庆幸的是,随着我国针对抗癌救命药推出一系列市场化改革举措,国内新药的上市速度已显著提升。未来,随着更多靶向药、PD-1、双抗、CAR-T细胞疗法等纳入医保审查范围,相信会有越来越多的抗癌新药进入医保目录,惠及广大癌症患者。
此外,目前有上百种抗癌新药的临床试验正在招募国内患者。癌友们可致电医学部,获取2025年通过初审的目录外药物完整清单,或了解更多抗癌新药/新技术的详细入组标准,初步评估能否通过方舟计划获得免费用药的机会。
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐

愈见大"CAR"|C
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

愈见大"CAR"|破
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
晚期肺癌治疗的"双保险&quo
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
全球首款双功能新药中国获批上市!另附20
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

全球肿瘤医生网官宣!GLOBE肿瘤创新药
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

改写乳腺癌宿命!mRNA疫苗+CD27抗
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







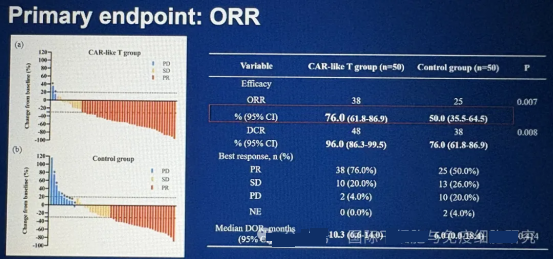
![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




