里程碑!国内首个TCR-T疗法获药监局临床批件,缩瘤率88%,实体瘤利刃横扫肺癌、肠癌等
里程碑!国内首个TCRT细胞疗法获药监局临床批件,缩瘤率88%,实体瘤利刃横扫肺癌、肠癌等
2025年5月15日,广州市香雪制药股份有限公司宣布:其子公司香雪生命科学已收到国家药品监督管理局(NMPA)于2025年5月签发的《药物临床试验批准通知书》(编号:2025LP01317)。经审查,TAEST1901注射液符合《中华人民共和国药品管理法》及相关规定的药品注册要求,NMPA同意其开展临床试验,用于基因型为HLA-A*02:01且肿瘤抗原AFP表达阳性的晚期胃癌的治疗。
TAEST1901注射液为TCR-T细胞疗法,通过慢病毒转导自体T细胞,使其表达AFP抗原特异性的T细胞受体(TCR),进而靶向HLA-A*02:01与AFP抗原肽形成的复合物。值得关注的是,该产品早在2022年4月就已获得NMPA新药临床注册批准,适应症覆盖HLA-A*02:01基因型、AFP抗原阳性的晚期肝癌或其他晚期肿瘤,目前针对首个适应症(晚期肝癌)的1期临床试验正稳步推进。
此次晚期胃癌新适应症的临床批准,标志着我国在实体瘤免疫治疗领域取得了新的突破。期待这款靶向实体瘤的TCR-T疗法在后续临床研究中取得积极成果,为更多肿瘤患者提供新的治疗选择。

▲截图源自“Finance”
精准狙击肿瘤的"细胞利刃",让T细胞"精准导航",直抵肿瘤病灶
T细胞受体工程化T细胞(TCR-T)是过继性细胞移植(ACT)的重要亚型,同时属于细胞免疫疗法范畴。其技术流程为:先识别并筛选能特异性结合靶抗原的TCR(T细胞受体)序列,再从患者外周血中获取T细胞,通过基因工程改造使其表达该特定TCR,最后将修饰后的T细胞回输患者体内。以此实现对表达靶抗原肿瘤细胞的选择性识别与清除,进而达到癌症治疗目的。
目前,部分TCR-T产品已在国内外用于治疗难治性/复发性黑色素瘤、滑膜肉瘤、多发性骨髓瘤、肺癌等疾病,并在多项临床试验中展现出良好的安全性与有效性。相较于CAR-T疗法,TCR-T具有更强的实体瘤穿透力、更高的肿瘤细胞特异性,且免疫排斥及抗体产生风险更低。
CAR-T与TCR-T的核心区别在于识别肿瘤细胞的机制不同:CAR-T通过基因工程改造T细胞,使其表达嵌合抗原受体(CAR),从而识别肿瘤细胞表面的非主要组织相容性复合体(MHC)限制性抗原;而TCR-T则是对T细胞的天然受体进行改造,使其靶向肿瘤细胞表面的MHC限制性抗原。
这一特性也带来了TCR-T的关键优势:其一,其靶向的MHC限制性抗原通常在肿瘤细胞表面高表达,确保了对肿瘤细胞的精准识别与攻击;其二,由于采用的是天然T细胞受体而非人工合成的CAR,其免疫原性更低,大幅降低了引发机体免疫反应的可能性。
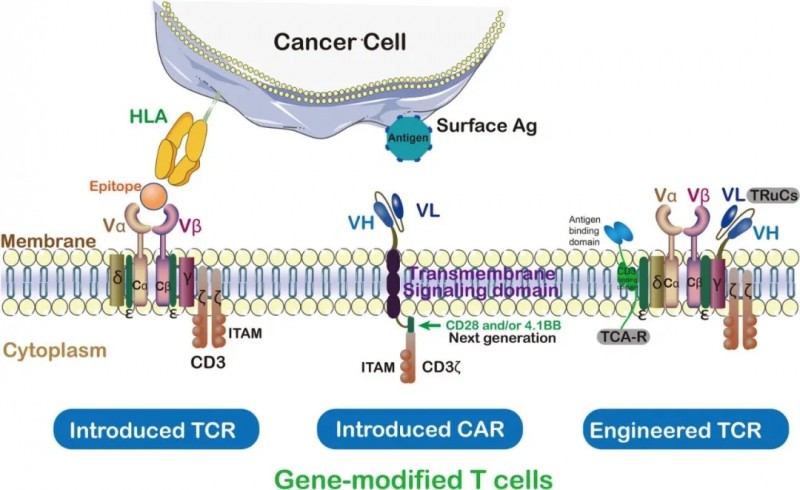
TCR-T疗法:实体瘤治疗的"全能选手",在黑色素瘤、肺癌、结直肠癌中均获关键进展
全球首例!靶向CEA的TCR-T疗法实现转移性结直肠癌客观消退,结直肠癌转移灶最大缩小49%,CEA骤降99%
癌胚抗原(CEA)是一种分子量为180kDa的糖蛋白,隶属于免疫球蛋白超家族,同时也是典型的肿瘤相关蛋白——它在多种上皮癌中呈过表达状态,尤其在结直肠腺癌中表现突出。不过,CEA并非肿瘤特异性蛋白,在胃肠道的多种正常上皮细胞中也有表达,其中以结肠隐窝上1/3处的高分化上皮细胞中表达最为显著。
目前,针对CEA的癌症免疫疗法(如疫苗、抗体等)正处于积极探索阶段。研究人员为此开发了一种针对转移性结直肠癌的治疗方案:通过基因工程改造患者自体T细胞,使其表达高亲和力T细胞受体(TCR),该TCR可介导对CEA的特异性识别。
《Molecular Therapy》期刊曾报道过一项里程碑式临床案例:应用此类靶向CEA的TCR-T细胞治疗后,转移性结直肠癌实现客观消退——这也是全球首个通过过继性T细胞转移达成该疗效的案例。
该研究共纳入3例HLA-A*0201阳性、且对标准疗法无效的转移性结直肠癌患者,均接受了上述靶向CEA的TCR-T细胞注射治疗。
结果显示:治疗前,所有患者的血清CEA水平介于226~865µg/l之间;过继细胞移植后,血清CEA水平均显著下降74%~99%(详见下图),但治疗后3~4个月,CEA水平有从低谷回升的趋势。
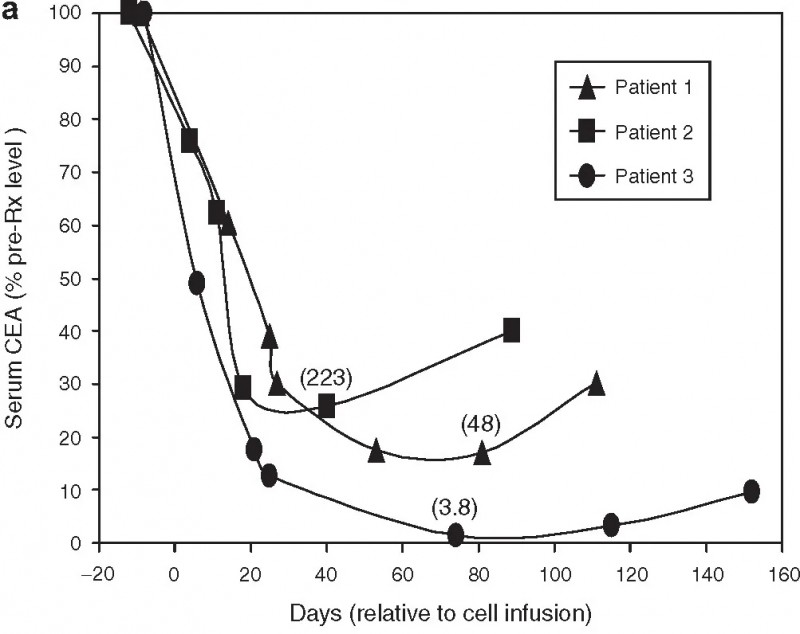
▲图源“Molecular Therapy”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
值得关注的是,有两例患者的转移灶出现客观消退:
患者1在过继细胞移植后2个月,肺癌转移灶缩小17%。
患者3在治疗后3个月的随访中,肝脏、肺部及主动脉旁淋巴结转移灶缩小34%,至治疗后4个月时肿瘤进一步缩小49%(图1b),符合RECIST标准定义的确认部分缓解(PR)。下图展示了患者3在治疗前、治疗后4个月的计算机断层扫描图像:箭头所示为结直肠癌转移灶位置,星号标记为此前经射频消融(RFA)治疗的肝转移部位所形成的肝脏缺损。
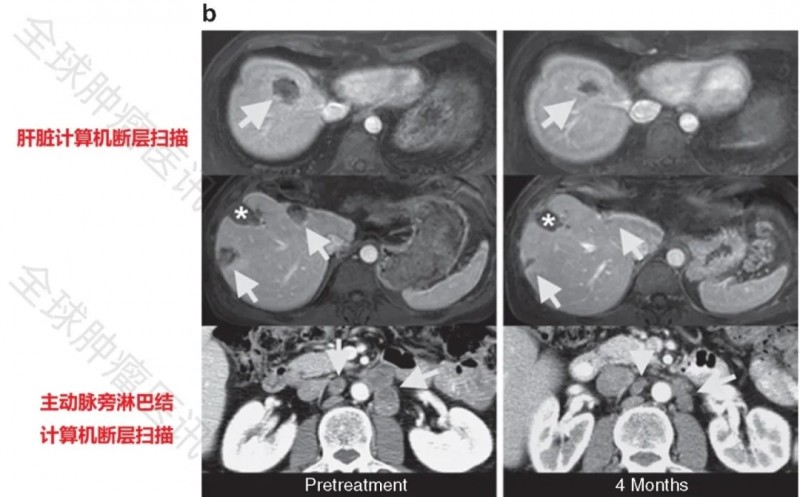
▲图源“Molecular Therapy”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
ADP-A2M10T细胞专攻非小细胞肺癌多线治疗后的"硬骨头"!肿瘤缩小25%,特定组生存期延长至211天
ADP-A2M10是一种经基因工程改造的自体T细胞,可表达针对黑色素瘤相关抗原A10(MAGE-A10)的高亲和力T细胞受体(TCR),并在人类白细胞抗原(HLA)-A*02的分子背景下靶向MAGE-A10阳性肿瘤。
《免疫肿瘤学杂志》报道了“ADP-A2M10治疗非小细胞肺癌(NSCLC)I期剂量递增试验(NCT02592577)”的振奋数据,该试验旨在评估其安全性与抗肿瘤活性。
该研究共纳入11例例HLA-A*02阳性、MAGE-A10表达的晚期非小细胞肺癌(NSCLC)患者,包括8例腺癌、3例鳞状细胞癌,且均至少接受过1次全身治疗(中位3次,范围:1-6次,包含免疫治疗/靶向治疗/放射治疗等)。入组后,患者先接受淋巴细胞清除化疗,随后接受ADP-A2M10治疗。
结果显示:依据RECISTV.1.1标准,最终7例患者可评估疗效,其中5例最佳总体疗效为疾病稳定(SD)。所有患者首次输注后的中位无进展生存期(PFS)为58天(范围1-89天),中位总生存期(OS)为132天(范围:10-458天)。总体治疗持续时间(DoSD)的中位值为61天(范围:52-89天)。其中剂量组3及扩展组的中位PFS为61天(范围:52-88天),中位OS为211天(范围:132-458天)。
值得一提的是,患者9对治疗有反应且ADP-A2M10持续存在。在首次输注后肿瘤缩小25%,随后接受第二次ADP-A2M10输注;第二次输注8周后,与基线相比实现经确认的部分缓解(PR)(详见下图A、B)。
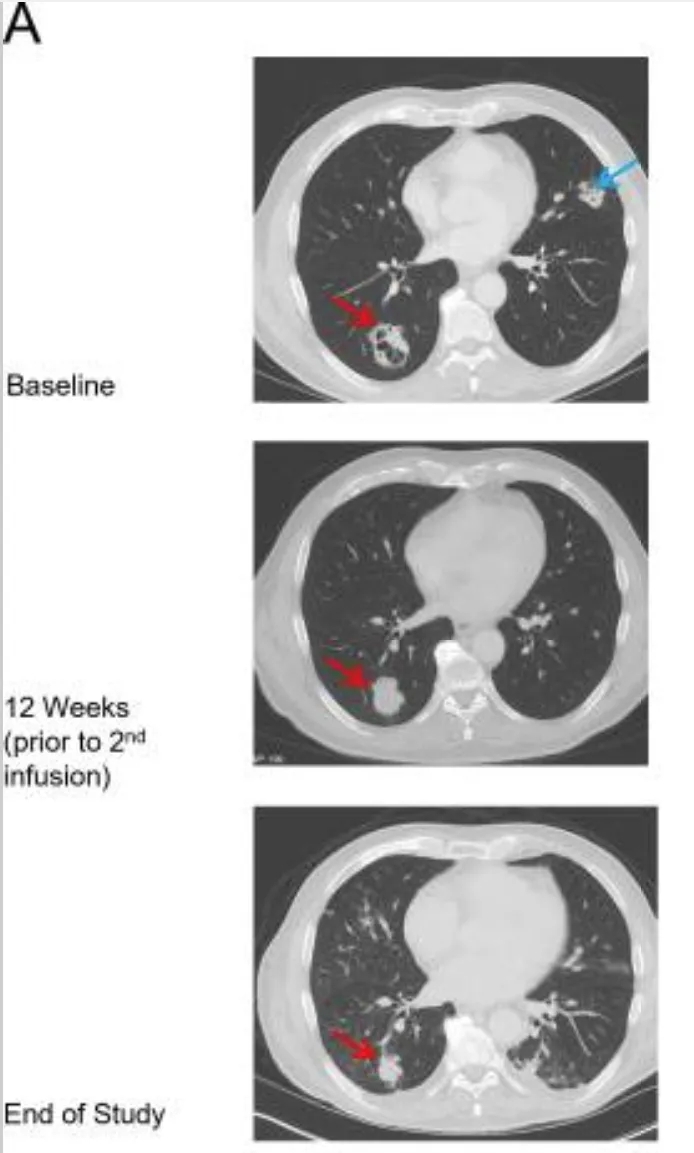
▲图源“J Immunother Cancer”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
注:
①红色箭头:代表肺右下叶(RLL)肿块。
②蓝色箭头:代表肺左上叶(LUL)肿块。
从"PD-1耐药复发"到"持久缓解":IMA203为晚期黑色素瘤点亮希望,cORR达54%,88%患者肿瘤缩小
未切除或转移性黑色素瘤患者在接受一线检查点抑制剂治疗后若出现复发,往往面临长期生存期有限的困境,迫切需要寻求新的治疗手段。
近年研究发现,PRAME作为一种细胞内蛋白,能以肽抗原形式高密度呈现在包括黑色素瘤在内的多种实体瘤表面。而ACTengineIMA203正是一款靶向PRAME的自体TCR-T细胞疗法,已在黑色素瘤、卵巢癌、滑膜肉瘤等多种肿瘤中展现出客观疗效潜力,其细胞可成功转运至多个器官,并能缩小肺、肝、胸膜、腹膜、皮肤、淋巴结等部位的转移性肿瘤病灶。
在2025 ASCO大会上,更新了“IMA203治疗PD-1难治性转移性黑色素瘤Ⅰa/b期临床试验(NCT03686124)”的振奋人心的数据。该研究共纳入70例接受过大量既往治疗的实体瘤患者(中位既往全身治疗次数为3种),其中Ⅰb期针对的是既往接受过多次系统性治疗(中位2次),且复发风险达到推荐Ⅱ期剂量(RP2D,1-10×10⁹)的黑色素瘤患者。
Ⅰb期核心结果显示:平均随访时间8.6个月,在26例黑色素瘤患者中,确认客观缓解率(cORR)达54%(14/26),88%(23/26)的患者实现肿瘤缩小;中位缓解持续时间(mDOR)为12.1个月,其中7例确认缓解患者的疗效持续时间已超过2年;中位无进展生存期(mPFS)为6个月,中位总生存期(mOS)尚未达到。
进一步数据显示:在33例经多线前期治疗的转移性黑色素瘤患者中,单次输注IMA203后,cORR为56%(18/32),mDOR为12.1个月(范围:1.8+~32.6+个月,中位随访13.4个月),mPFS为6.1个月(范围:1.4~34.0+个月,中位随访14.4个月),mOS为15.9个月(范围:2.4~34.2+个月,中位随访14.4个月)。值得关注的是,在皮肤黑色素瘤及葡萄膜黑色素瘤中,该疗法均展现出令人鼓舞的活性,cORR分别为50%(皮肤黑色素瘤) vs 67%(葡萄膜黑色素瘤)。
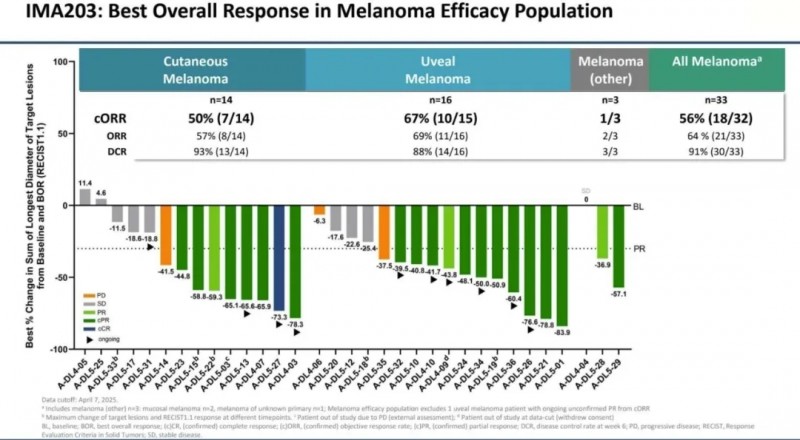
▲图源“ASCO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,IMA203TCR-T疗法耐受性良好,在晚期黑色素瘤患者中可实现持久的客观缓解,为经多线治疗后复发的患者提供了新的治疗选择。
HCT复发率高达40%?TSC-100/101双TCR-T疗法强势破局,为患者筑起"防复发"屏障
异基因造血细胞移植(HCT)后患者疾病复发率约为40%,且复发后死亡率居高不下。
TSC-100与TSC-101均为源自异基因供体的T细胞受体工程化T细胞(TCR-T),分别靶向HA-1和HA-2造血细胞抗原——这两种抗原均通过HLA-A02:01分子呈递。通过选择HA-1阴性供体制备TSC-100、选择HLA-A02:01阴性供体制备TSC-101,可选择性清除HCT后患者体内残留的造血细胞,进而防止疾病复发(详见下图)。
TSCAN-001(临床试验编号:NCT05473910)是一项多中心、多组、对照的Ⅰ期临床试验,旨在评估TSC-100与TSC-101对特定患者的疗效:这些患者为适合接受低强度预处理单倍体相合供体移植的成人急性髓系白血病(AML)、骨髓增生异常综合征(MDS)或急性淋巴细胞白血病(ALL)患者。
该研究共入组11例患者,其中治疗组7例(TSC-101组4例、TSC-100组3例),对照组4例。造血干细胞移植后的中位随访时间为162天(范围2-339天),整个研究的中位随访时间则为9个月(270天,范围72-608天)。
结果显示:11例入组患者中3例(约27%)出现复发;而根据国际骨髓移植研究中心(CIBMTR)的数据,同类患者HCT后6个月复发率为18%-20%。
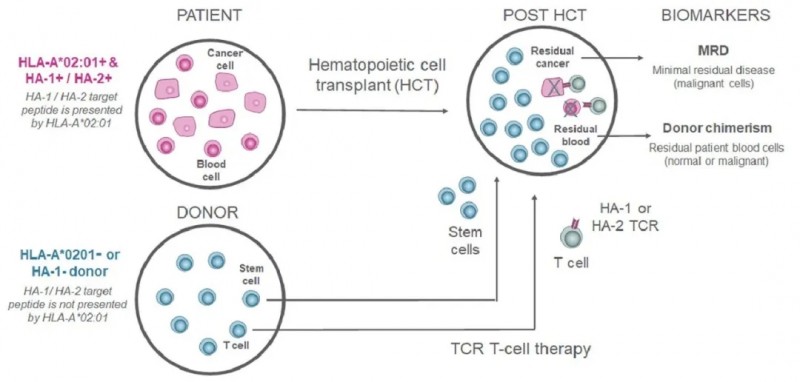
▲图源“ASTCT”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上所述,异基因造血细胞移植(HCT)后应用TSC-100与TSC-101,可诱导供体完全嵌合及微小残留病(MRD)阴性,进而显著降低患者复发率。
小编寄语
虽然,TCR-T疗法与CAR-T同属于T细胞疗法,但TCR-T疗法的靶抗原范围更为广泛,被视作对抗实体瘤战场上的超级利刃,蕴藏着巨大潜力!尤为令人振奋的是,TCR-T疗法创新性地开辟出一条“一箭双雕”的神奇治疗路径,在同时向癌症和病毒感染发起猛烈攻击时,展现出令人惊叹的有效性、安全性与可行性。正因如此,近些年来,研究人员大胆尝试将TCR-T疗法应用于宫颈癌、乙肝病毒相关肝细胞癌、肺鳞癌、卵巢癌、三阴乳腺癌、滑膜肉瘤、黑色素瘤、食管癌等癌种的治疗。事实证明,他们的努力取得了令人瞩目的成就,TCR-T疗法在这些癌种的治疗中大放异彩,无疑为癌症治疗领域注入了一剂强心针,带来了全新的希望之光!
想寻求TCR-T、CAR-T、TILs疗法或国内外其他抗癌新技术帮助的病友,可将治疗经历、近期病理报告及影像学检查结果等资料,提交至医学部,进行初步评估或申请国内外抗癌会诊,以寻求适合自己的个体化治疗方案。
参考资料
[1]Wermke M,et al.Phase 1 clinical update of IMA203, an autologous TCR-T targeting PRAME in patients with PD1 refractory metastatic melanoma[J]. 2025.
https://meetings.asco.org/abstracts-presentations/244341
[2]Al Malki M M,et al.TSC-100 and TSC-101, TCR-T cell therapies that target residual recipient cells after reduced intensity conditioning transplantation, induce complete donor chimerism with favorable prognosis: early results of a phase 1 trial[J]. Transplantation and Cellular Therapy, Official Publication of the American Society for Transplantation and Cellular Therapy, 2024, 30(2): S1-S2.
https://www.astctjournal.org/article/S2666-6367(23)01755-4/fulltext
[3]Parkhurst M R,et al.T cells targeting carcinoembryonic antigen can mediate regression of metastatic colorectal cancer but induce severe transient colitis[J]. Molecular Therapy, 2011, 19(3): 620-626.
https://www.cell.com/molecular-therapy-family/molecular-therapy/fulltext/S1525-0016(16)30411-7?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS1525001616304117%3Fshowall%3Dtrue
[4]Blumenschein GR,et al.Phase I clinical trial evaluating the safety and efficacy of ADP-A2M10 SPEAR T cells in patients with MAGE-A10+ advanced non-small cell lung cancer. J Immunother Cancer. 2022 Jan;10(1):e003581.
https://pmc.ncbi.nlm.nih.gov/articles/PMC8796260/
[5]https://file.finance.sina.com.cn/211.154.219.97:9494/MRGG/CNSESZ_STOCK/2025/2025-5/2025-05-15/11112807.PDF
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐

4个月婴儿确诊致命脑瘤被判死刑,革命性抗
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

胰腺癌实现完全缓解!2026癌症疫苗,T
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
22款肺癌新药扎堆上市!2026这些基因
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
66.7%显著缩小 + 60周持续完全缓
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
"打一针"实现长期生
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

国研双抗突破实体瘤困局!首次人体研究结果
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05









![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




