晚期难治肝癌首个TCR-T疗法来了!最长存活超5年!另乳腺癌、肺癌、肉瘤等首试数据更新
首个难治性肝癌TCRT细胞疗法ADP-A2AFP来了,最长生存超5年,另乳腺癌、肺癌、肉瘤等首试数据更新
晚期肝细胞癌(HCC)患者即便接受现有标准疗法,预后通常仍不理想,临床对更有效的替代治疗方案存在迫切需求。
近期,《肝病学杂志》公布了关键疗法ADP-A2AFP的首次人体临床试验数据——作为首个在晚期难治性肝细胞癌中开展评估的TCR-T细胞疗法,其交出了颇具突破性的答卷:疾病控制率(DCR)高达66.7%。这一成果不仅有力验证了ADP-A2AFP在难治性实体瘤治疗中的潜力,更让TCR-T这一新型细胞疗法再次成为抗癌领域的关注焦点。
值得关注的是,近期TCR-T疗法的多项“首次人体试验”同步推进,且在乳腺癌、肺癌、肉瘤、黑色素瘤等多个实体瘤领域均取得突破性进展。对于长期面临治疗困境的实体瘤患者而言,这些亮眼数据无疑点亮了新的希望曙光!
晚期难治性肝癌迎来首个TCR-T评估疗法!ADP-A2AFP首个人体试验交出亮眼答卷:病灶最大缩小近5成,DCR达66.7%,最长生存超5年
ADP-A2AFP是一款在研自体T细胞疗法,其核心为亲和力增强型T细胞受体(TCR),可精准靶向甲胎蛋白(AFP)。为评估该疗法的疗效与安全性,研究团队开展了一项I期首次人体临床试验(NCT03132792),共纳入21例患者——均经组织学确诊为肝细胞癌(HCC)或其他AFP表达阳性肿瘤,且不适合移植或手术切除,其中包括20例晚期HCC患者、1例胃肝样癌患者。所有入组患者先接受淋巴细胞清除化疗(环磷酰胺联合氟达拉滨)预处理,随后静脉输注ADP-A2AFP。
结果显示:在21例可评估患者中,总体反应率(ORR)达9.5%,疾病控制率(CR+PR+SD)更是高达66.7%,包括1例完全缓解(CR)、1例部分缓解(PR)、12例达病情稳定(SD),且所有缓解者均为HCC患者(具体缓解情况见图1)。其中14例患者在首次输注后的SD持续时间介于6.7~73.0周之间,另有8例患者的病情稳定持续时间≥16周。
从个体疗效数据来看,CR患者基线时肝脏存在2个靶病灶,直径总和为37毫米;PR患者基线时有4个靶病灶(含2个肝脏病灶、2个淋巴结病灶),病灶直径总和从基线时的236.9mm,输注后第4周降至143.3mm(降幅39.5%)、输注后第第8周降至123.6mm(降幅47.8%)。值得一提的是,在长期随访中,1例患者在首次输注后约5.0年的最后一次随访时仍存活。
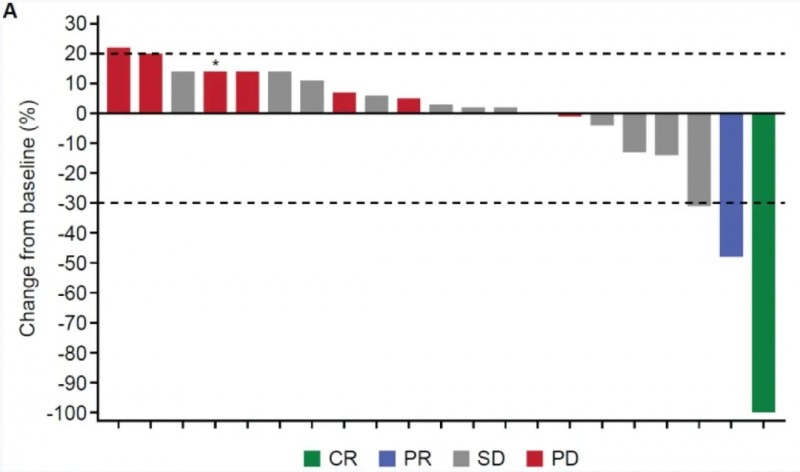
▲图源“Journal of hepatology”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,对于上述经前期治疗的患者,在淋巴细胞清除化疗后给予ADP-A2AFPTCRT细胞疗法,初步显示出可控的安全性与抗肿瘤活性迹象,为后续该疗法的研发与临床应用提供了重要一举。
好消息是,目前国内多家癌症中心启动TCR-T疗法的临床试验,主要针对肺鳞癌、卵巢癌、三阴乳腺癌、滑膜肉瘤、黑色素瘤、食管癌、肝癌等多癌种,进行临床招募。
做过基因检测的病友可以拿出报告看看,一旦存在上述癌症种类或突变,可联系医学部,进行初步评估,看不懂报告检测的病友,也可以致电医学部详细阅读。
neoTCR疗法首战难治性实体瘤告捷!乳腺癌病灶缩17%、肺癌实现病情稳定
T细胞受体(TCR)是T细胞特异性识别癌细胞突变的关键分子。为此,研究人员开发了一种能够有效分离多种针对突变型新抗原的TCR的方法——neoTCR,基于CRISPR–Cas9的非病毒精准基因组编辑,可同时敲除编码TCRα的TRAC基因与编码TCR β的TRB C基因这两个内源性TCR基因,并公布了Ia期首次人体临床试验(NCT03970382)数据。
该研究共纳入16例难治性实体瘤患者,包括11例微卫星稳定型结直肠癌、2例激素受体阳性乳腺癌、1例卵巢癌、1例黑色素瘤、1例肺癌。中位年龄为47岁(范围36-70岁),既往已接受中位5线治疗(范围:2-9线)。入组后,所有患者均被分配至3个剂量组,接受对应剂量的neoTCR转基因T细胞输注。
结果显示:该疗法的最佳疗效为病情稳定(SD),共5例患者达到这一终点;同时,研究也证实了高效分离并克隆多种可识别突变新抗原的TCR的可行性。
值得注意的是,有2例患者的部分靶病灶出现缩小:
剂量水平1组的0010号患者:确诊为转移性乳腺癌,此前已接受过七种疗法。在输注neoTCR后第28天,其靶病灶最大直径总和较基线减少17%,或与预处理方案中的高剂量环磷酰胺相关。
另一例试验末位入组患者(编号1003):确诊为转移性非小细胞肺癌,累计接受过6线治疗,接受高剂量皮质类固醇治疗4天后,相关症状缓解;输注neoTCR后第28天首次肿瘤评估显示,患者达到病情稳定(SD),靶病灶总数较基线减少2%——其中肝脏、淋巴结及卵巢部位的靶病灶均有缩小(详见下图)。尽管未获取治疗后活检样本以验证T细胞浸润情况或靶向新抗原状态,但外周组织中检测到高比例的neoTCR转基因T细胞,且部分靶病灶确实缩小,这些证据均提示该疗法或具有一定疗效。
▼1003号患者在基线(第-12天,左图)、治疗期间(第30天,右图)的计算机断层扫描
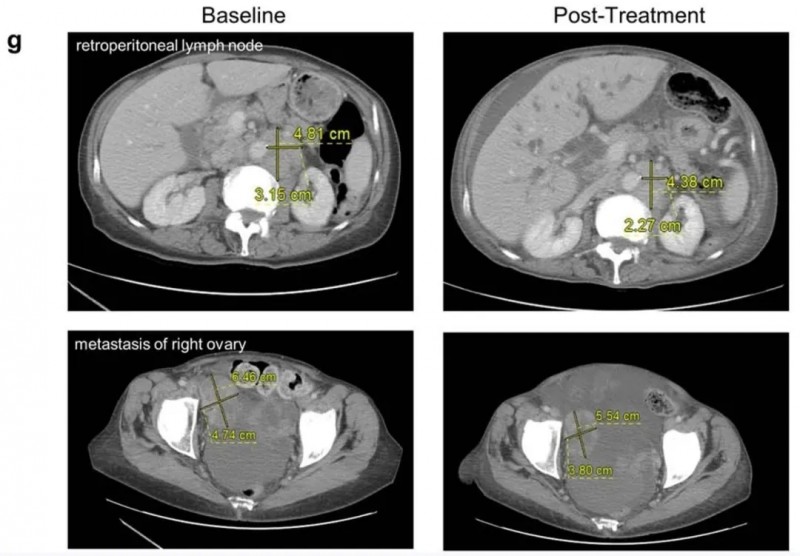
▲图源“nature”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
NY-ESO-1 TCR-T疗法暴击难治肉瘤与黑色素瘤,首次人体试验长期生存数据亮眼:5年生存率达33%,最长缓解近4年
NY-ESO-1(癌种系抗原,简称CG抗原)在滑膜细胞肉瘤与黑色素瘤中呈高表达特征,表达率分别达70%-80%与25%。基于这一靶点优势,研究团队研发出可识别NY-ESO-1的反应性T细胞受体(TCR)转导自体T细胞(即通过改造自体外周血单核细胞,使其携带靶向NY-ESO-1的TCR),并公布了该疗法首次人体临床试验的长期随访数据及疗效相关性结果。
该试验共纳入38例既往接受过大量治疗的转移性癌症患者,均满足“HLA-A*0201阳性+NY-ESO-1阳性”的入组标准,包括18例转移性滑膜细胞肉瘤患者、20例转移性黑色素瘤患者。所有患者入组后先接受非清髓性化疗预处理,随后输注NY-ESO-1 TCR转导的自体T细胞。
结果显示:两类癌种患者均观察到明确且具有临床意义的疗效:
滑膜肉瘤
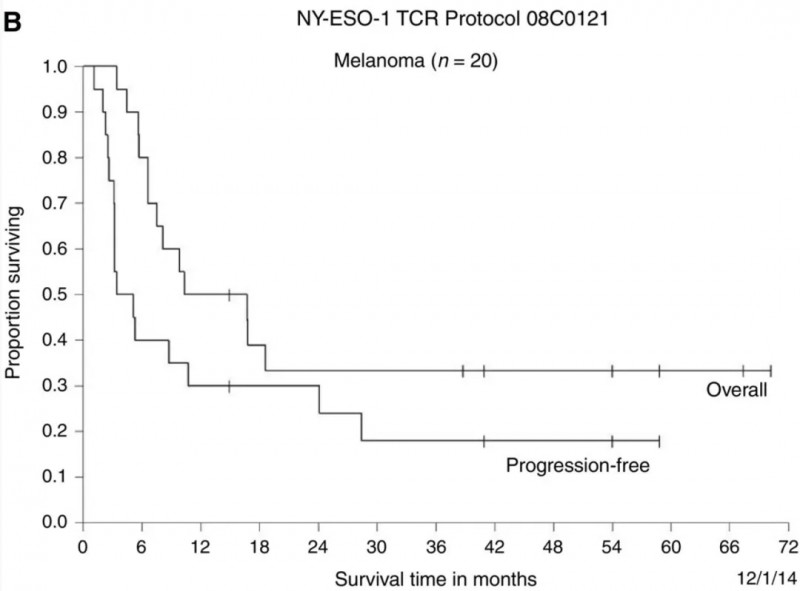
在18例转移性滑膜细胞肉瘤患者中,根据RECIST(实体瘤疗效评价标准),11例(61%)达到客观临床反应(表2、3),部分缓解(PR)持续3~18个月。在生存数据方面,此类患者3年总生存率预计为38%,5年总生存率预计为14%(详见下图)。
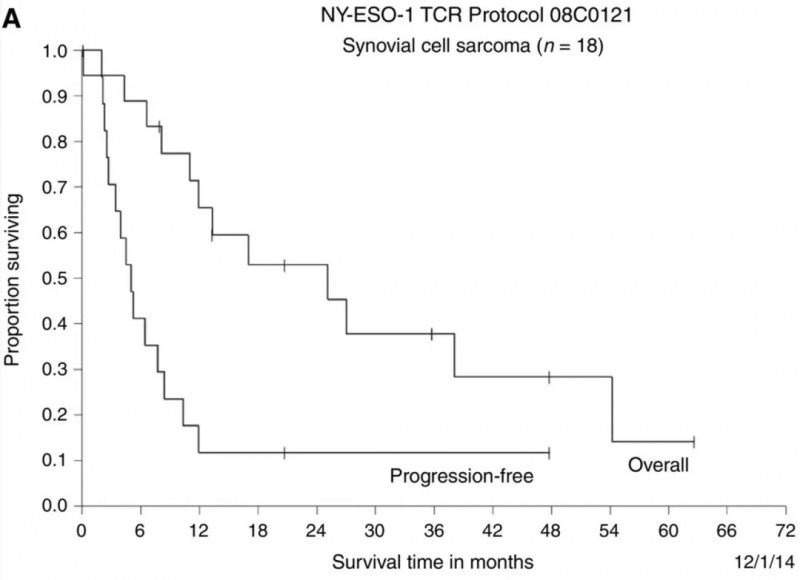
▲图源“AACR”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
值得一提的是,更有2例滑膜肉瘤患者实现长期深度缓解:
患者7:多发性肺转移灶几乎完全消退,大型骨盆骨性病变也显著消退,且缓解在治疗后均持续近4年(详见下图)。
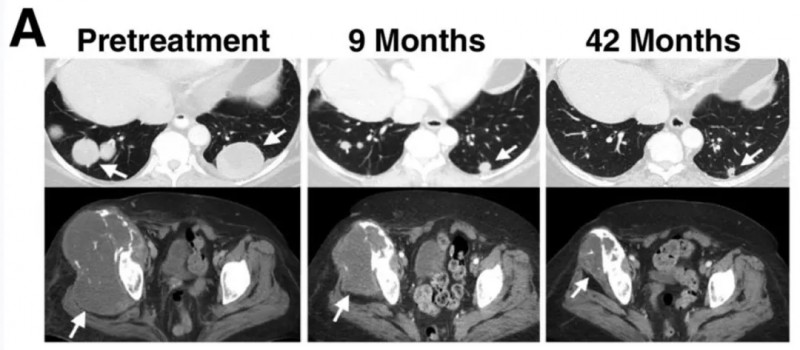
▲图源“AACR”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
患者15:所有转移性病变(包括多发性肺转移灶)均完全消退,且在治疗后,缓解持续超过一年(详见下图)。
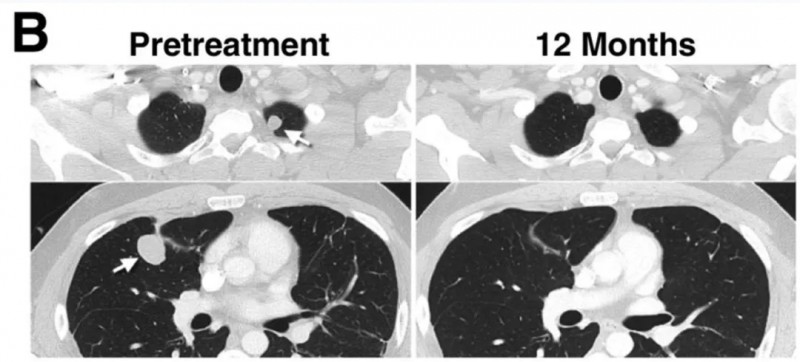
▲图源“AACR”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
黑色素瘤
在20例转移性黑色素瘤患者中,11例(55%)在第一次使用1G4-αLYTCR转导的T细胞治疗后,达到客观反应,4例实现完全缓解(CR),其中3例患者的缓解持续时间长达40-58个月。7例患者实现部分反应(PR),持续时间为3-28个月。生存数据上,该类患者的3年与5年总生存率估计均为33%(详见下图)。
▲图源“AACR”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
值得一提的是,有两例患者的情况值得广泛关注:其中患者37在细胞过继转移后6个月仍维持部分反应;而患者29则达到完全缓解(CR),TCR-T治疗后,其多发性肝转移(详见下图C)与肺转移灶均明显消退(详见下图D)。
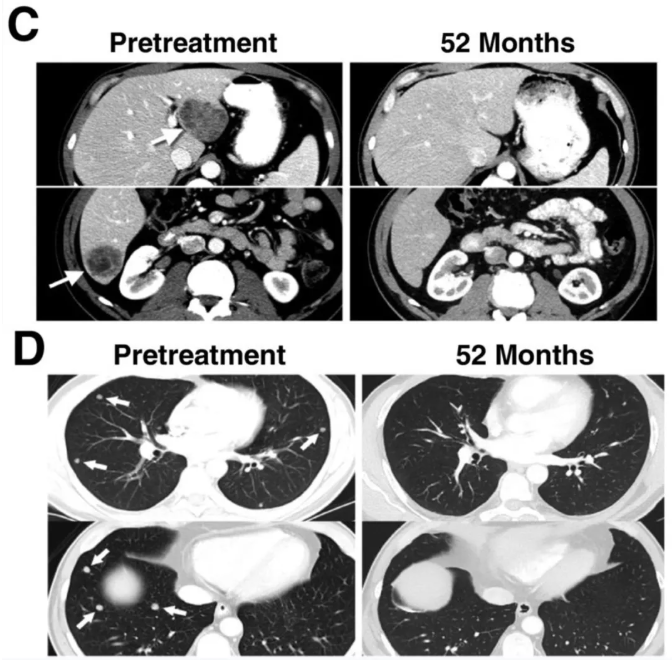
▲图源“AACR”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
小编寄语
TCR-T疗法创新性地开辟出一条“一箭双雕”的神奇治疗路径,在同时向癌症和病毒感染发起猛烈攻击时,展现出令人惊叹的有效性、安全性与可行性。正因如此,近些年来,研究人员大胆尝试将TCR-T疗法应用于宫颈癌(主要由人乳头瘤病毒,即HPV感染引发)、乙肝病毒相关肝细胞癌等癌种的治疗。事实证明,他们的努力取得了令人瞩目的成就,TCR-T疗法在这些癌种的治疗中大放异彩,无疑为癌症治疗领域注入了一剂强心针,带来了全新的希望之光!
更大的好消息是,多款在研TCR-T治疗正针对妇科肿瘤(宫颈癌、卵巢癌)、肺鳞癌、三阴乳腺癌、滑膜肉瘤、黑色素瘤、食管癌等开展临床试验,中国患者可有机会同步参与前沿治疗!如果也想寻求TCR-T、CAR-T、TILs等新兴抗癌治疗的帮助,将近期病理检查结果、治疗经过等资料,提交至医学部,进行初步评估!
参考资料
[1]Meyer T,et al.Phase I trial of ADP-A2AFP TCR T-cell therapy in patients with advanced hepatocellular or gastric hepatoid carcinoma[J]. Journal of hepatology, 2025.
https://www.journal-of-hepatology.eu/article/S0168-8278(25)02404-3/fulltext
[2]Foy S P,et al.Non-viral precision T cell receptor replacement for personalized cell therapy[J]. Nature, 2023, 615(7953): 687-696.
https://www.nature.com/articles/s41586-022-05531-1#citeas
[3]Robbins P F,et al.A pilot trial using lymphocytes genetically engineered with an NY-ESO-1–reactive T-cell receptor: long-term follow-up and correlates with response[J]. Clinical Cancer Research, 2015, 21(5): 1019-1027.
https://aacrjournals.org/clincancerres/article/21/5/1019/248147/A-Pilot-Trial-Using-Lymphocytes-Genetically
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐

4个月婴儿确诊致命脑瘤被判死刑,革命性抗
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

胰腺癌实现完全缓解!2026癌症疫苗,T
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
22款肺癌新药扎堆上市!2026这些基因
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
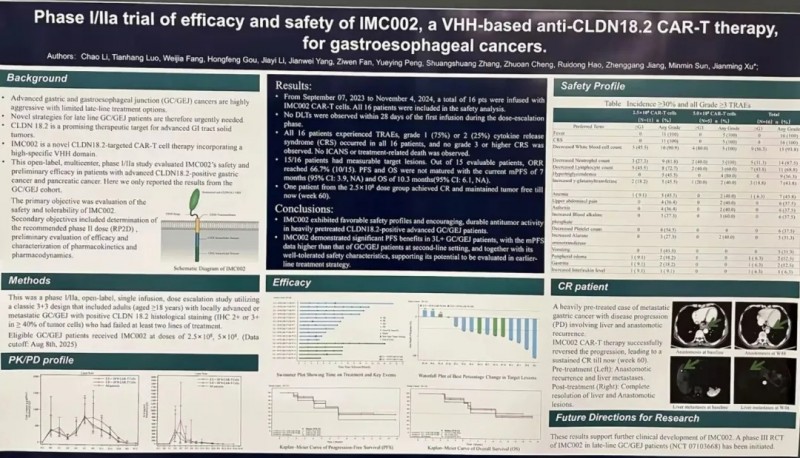
66.7%显著缩小 + 60周持续完全缓
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
"打一针"实现长期生
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

国研双抗突破实体瘤困局!首次人体研究结果
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05








![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




