硬核抗癌!MD安德森六项"救命研究"齐发,重塑白血病/肺癌/肠癌/卵巢癌等预后
硬核抗癌!美国MD安德森癌症中心六项“救命研究”齐发,重塑白血病/肺癌/肠癌/卵巢癌等预后
作为全球癌症研究的引领者,MD安德森癌症中心的研究团队在过去一年持续突破医学边界——从推动临床试验成果加速获得美国食品药品监督管理局(FDA)批准,到开展为癌症治疗突破筑牢基础的探索性研究,更以一份亮眼答卷彰显硬核科研实力:近一年来,10700名患者参与其临床试验,406篇研究成果发表于国际知名期刊。
在最新年度总结中,更重磅推出18项“仅能在MD安德森实现”的突破性进展——其中多项已成功落地转化,成为切实可行的“救命方案”,从实验室的创新探索到临床的生命救援,为癌症患者带来直接且迫切的治疗希望!

▲图源“MD Anderson”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
MD安德森发布六项"救命研究",直击白血病、肺癌、结直肠癌、卵巢癌、甲状腺癌等
新型obe-cel CAR-T细胞疗法:在成人晚期B细胞急性淋巴细胞白血病中,斩获77%高缓解率
obe-cel(Aucatzyl,obecabtagene autoleucel)是一款靶向CD19的自体41BB-ζ嵌合抗原受体(CAR)T细胞免疫疗法,其采用中等亲和力CAR设计,可有效减少毒性并提升疗效持久性,同时也是首个无需风险评估缓解策略(REMS)计划的CAR-T疗法。2024年11月8日,该疗法获美国食品药品监督管理局(FDA)批准,用于治疗成人复发或难治性B细胞前体急性淋巴细胞白血病(r/r B-ALL)。
安德森报道了一项全球性Ib/II期FELIX研究(NCT04404660)的关键数据——针对复发或难治性CD19阳性B细胞急性淋巴细胞白血病(ALL)成人患者(≥18岁)评估其治疗效果,该研究结果已同步发表于《新英格兰医学杂志》,证实obe-cel兼具显著长期疗效、高缓解率及极低免疫毒性,更为美国食品药品监督管理局(FDA)批准其作为特定难治患者群体的独立疗法提供了关键支持。
该FELIX研究共纳入153例r/r CD19阳性B细胞ALL成人患者(≥18岁),其中127例(83.0%)接受至少一次obe-cel输注并完成疗效评估,中位随访时间21.5个月(范围8.6~41.4个月)。核心疗效数据如下:
1、在2A亚组中(94例,中位随访20.3个月):总体缓解率为77%(95%CI:67%~85%),其中完全缓解率(CR)为55%(95%CI:45%~66%),伴有不完全血液学恢复的完全缓解率为21%(95%CI:14%~31%);中位缓解持续时间为14.1个月(95%CI:8.2个月~无法评估,详见下图),中位无事件生存期为9.0个月(95%CI:6.1~15.0个月)。
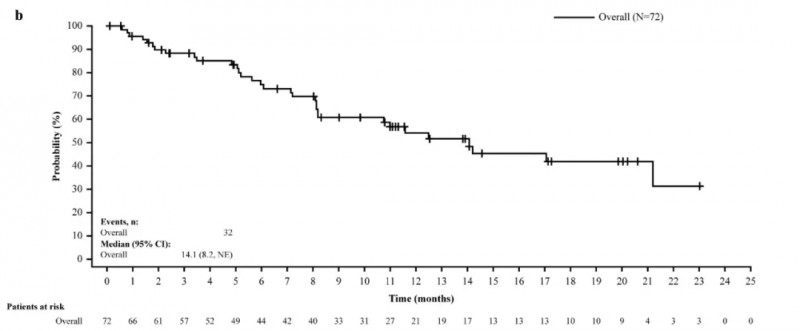
▲图源“N Engl J Med”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
2、在接受至少一次obe-cel输注的127例患者中(中位随访21.5个月):中位无事件生存期为11.9个月(95%CI:8.0~22.1个月,详见下图A),6个月和12个月无事件生存率分别为65.4%、49.5%;中位总生存期(OS)为15.6个月(95%CI:12.9个月~无法评估,详见下图C),6个月和12个月总生存率分别为80.3%、61.1%。
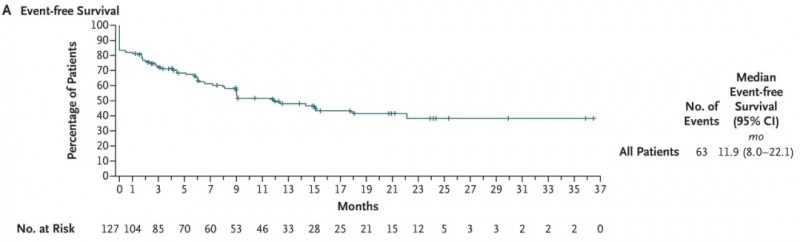
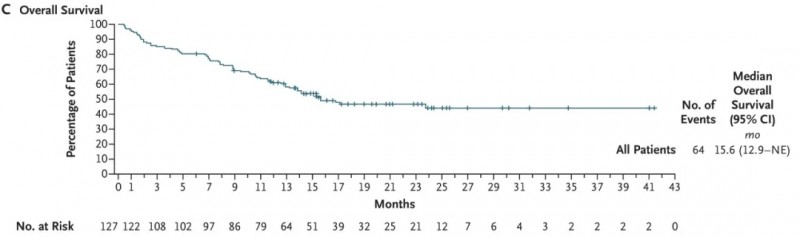
▲图源“N Engl J Med”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
中国患者如何寻求CAR-T疗法帮助
曾经,CAR-T这项先进的治疗技术一直掌握在医疗水平发达的国家,很多病友在苦苦等待中遗憾离开。值得中国病友们振奋的是,“天价”疗法不再遥不可及,中国已成功研发出多款针对多款血液肿瘤及实体瘤的CAR-T疗法,并在国内多家知名癌症中心启动临床,主要针对以下癌种:
1、血液肿瘤:包括但不限于淋巴瘤、白血病、多发性骨髓瘤等。
2、实体瘤:包括但不限于肝癌、结直肠癌、胰腺癌、胃癌、乳腺癌、卵巢癌、头颈部肿瘤等。
想寻求CAR-T及其他国内外新抗癌治疗帮助的患者,可以先将病历提交至医学部,进行初步评估,一旦审核通过,有机会获得”天价“疗法免费治疗的机会。
新工具有助于识别关键靶点:加强CAR-NK细胞疗法
经基因工程改造的同种异体CAR-NK细胞,已在晚期血液系统恶性肿瘤中展现出良好的安全性与有效性。而本研究进一步填补了“克服肿瘤及微环境(TME)免疫抑制的有效基因靶点”探索空白,为CAR-NK细胞疗法的升级提供了关键突破。
研究团队成功开发出全基因组CRISPR筛选平台PreCiSE,核心优势在于可直接在原代人NK细胞中开展功能缺失筛选,无偏倚分析调控细胞毒性、持久性及免疫抑制抵抗的基因程序,相关成果发表于《癌细胞》杂志。通过在反复肿瘤刺激和免疫抑制应激条件下的高通量筛选,研究鉴定出MED12、ARIH2和CCNC等关键调控基因——敲除这些基因后,NK细胞的抗肿瘤活性实现全方位提升:不仅体外和体内对多种难治性人类癌症的杀伤能力显著增强,代谢适应性、促炎细胞因子分泌水平及细胞毒性NK细胞亚群占比也同步改善,其固有免疫与CAR介导的免疫功能均得到强化。
这一发现为开发更有效、更精准且能抵抗癌症免疫逃逸的新型NK细胞疗法提供了核心支撑,更有望突破现有疗法局限,大幅提升NK细胞疗法对血液瘤与实体瘤的综合治疗效果。
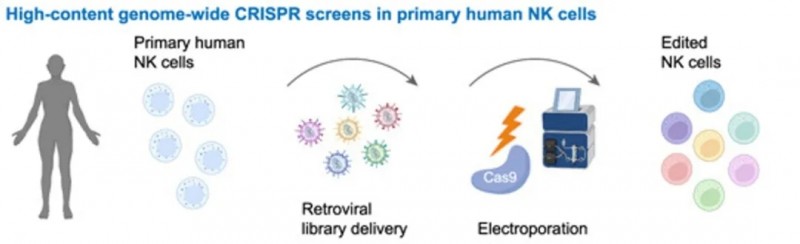
▲图源“Cancer cell”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
PPP2R1A基因突变:卵巢癌及多癌种免疫治疗生存率飙升的关键密码
卵巢透明细胞癌(OCCC)是一类治疗难度大、缺乏有效疗法的卵巢癌亚型。免疫检查点抑制剂(ICB)单药在晚期或复发性OCCC中的疗效有限,反应率仅5%-15%,且PD-L1表达、肿瘤突变负荷、BRCA1/2突变状态等传统生物标志物均无法有效预测治疗获益,开发精准免疫治疗策略及可靠疗效预测标志物,成为临床亟待解决的关键需求。
针对这一困境,一项发表于《自然》(Nature)的研究给出了突破性答案。该研究共纳入34例铂耐药OCCC患者,患者中位年龄56.0岁(范围:36.0-78.0岁),既往中位接受2线治疗(范围1-9线),均未接受过ICB治疗,中位随访时间13.7个月(范围1.0-70.3个月),所有患者均接受免疫组合疗法(度伐利尤单抗+替西木单抗)治疗。
核心研究结果显示:PPP2R1A基因失活体细胞突变(该基因编码蛋白磷酸酶2A(PP2A)复合物的核心支架蛋白)是预测OCCC患者该免疫组合疗法获益的关键生物标志物。与未携带该突变的患者相比,突变携带者的生存获益显著提升:中位总生存期(OS)分别为9.2个月 vs 66.9个月(超过5年,详见下图c),风险比为0.40(95%CI:0.15-1.08,P=0.031)。
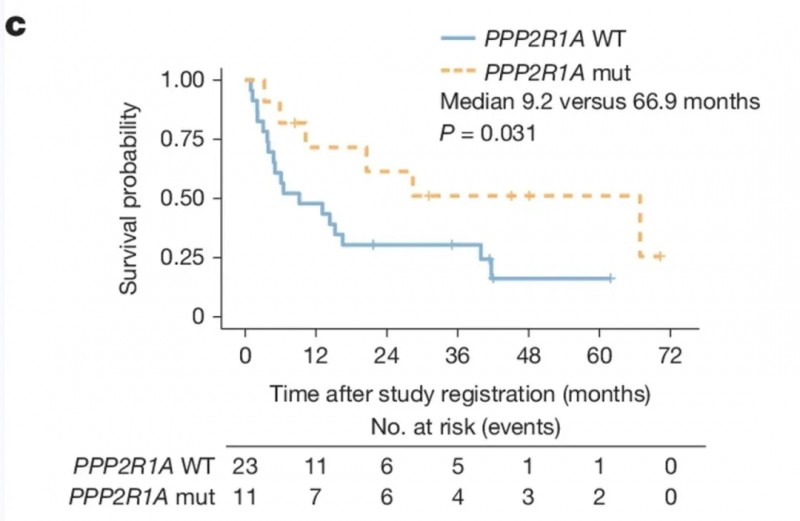
▲图源“Nature”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
此外,无进展生存期(PFS)也存在显著差异,突变携带者中位PFS为3.0个月,非突变携带者为1.8个月(单侧log-rank检验P =0.034;详见下图)。
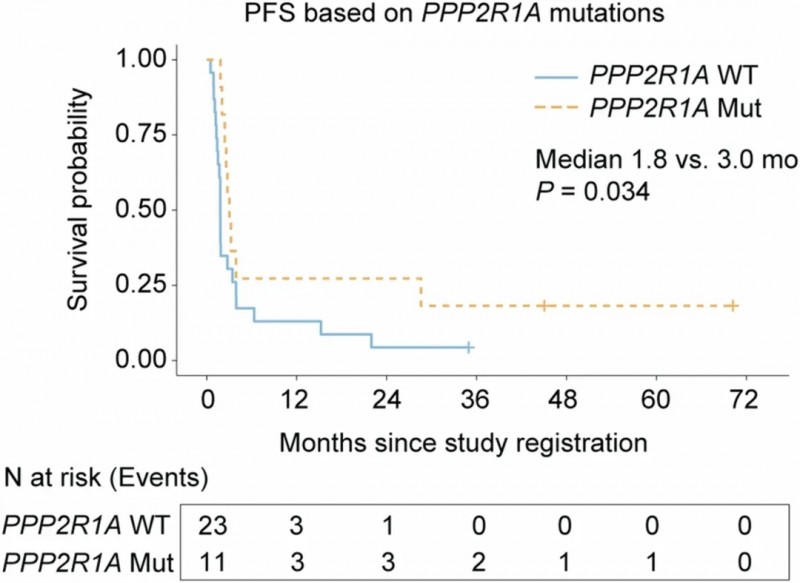
▲图源“Nature”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
值得一提的是,其中一例代表性患者的计算机断层扫描(CT)图像显示,治疗后肿瘤病灶随时间呈现明显缓解趋势(详见下图),进一步验证了该突变对应的治疗获益。
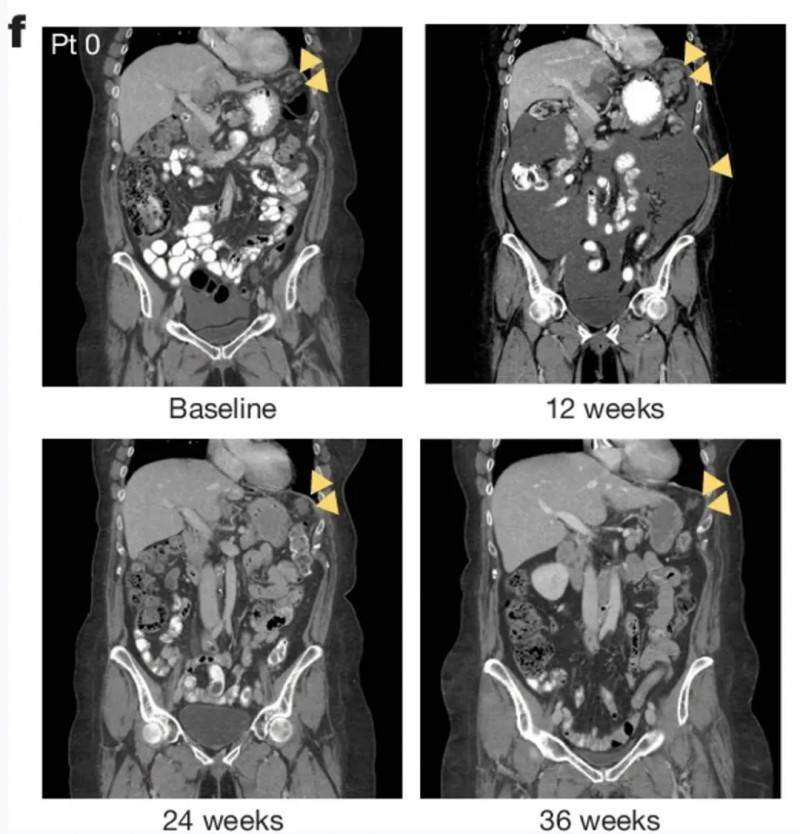
▲图源“Nature”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
· 肿瘤基因检测 ·
肿瘤基因检测(又称“基因组检测”“肿瘤 DNA 测序”“生物标志物检测”)是一项核心生物医学技术,通过分析个体基因序列、检测与肿瘤相关的基因突变,精准识别可能增加癌症患病风险的特定遗传变化,为肿瘤早发现、早干预提供科学依据,助力针对性预防或治疗措施的制定。
作为肿瘤精准诊治的基石,基因检测不仅为肿瘤早筛早诊提供了全新手段,更在临床中发挥多重关键作用:明确肿瘤诊断、指导靶向治疗与免疫治疗方案选择、监测治疗效果、评估肿瘤预后,同时还关联部分抗癌药的医保报销资格。在非小细胞肺癌、乳腺癌、前列腺癌等诸多癌症中,基因检测提供的分子病理结果已成为后续治疗决策的必要环节,可依据不同分子病理分型制定个性化治疗方案。
好消息是,目前我国部分省市(如北京、福建、山东、吉林等)已将基因检测项目纳入医保范畴,大大减轻了肿瘤患者的负担。此外,我们目前发起的方舟援助计划,针对符合条件的患者可给予1000-3000援助金,想申请的患者可致电医学部,了解检测详情或进行申请。
HER2靶向治疗宗格替尼:在经治HER2突变肺癌中展现强劲疗效
宗格替尼(Zongertinib)是一款口服不可逆的HER2选择性酪氨酸激酶抑制剂,既往研究已证实其对携带HER2改变的晚期或转移性实体瘤患者具有临床活性。
MD安德森癌症中心主导的Ia/Ib期Beamion LUNG-1试验(NCT04886804),进一步聚焦既往接受过治疗的晚期HER2突变型非小细胞肺癌患者,评估该药物的疗效与安全性。试验不仅取得了该癌症亚型中前所未有的71%缓解率,且药物具有每日口服一次的便利性优势。其初步数据成功推动美国食品药品监督管理局(FDA)启动优先审查,并于2025年初授予加速批准,更新后的核心研究结果已发表于《新英格兰医学杂志》。
本研究针对三类患者群体开展主要分析:队列1为肿瘤携带酪氨酸激酶结构域突变的患者;队列5为肿瘤携带酪氨酸激酶结构域突变且既往接受过HER2靶向抗体药物偶联物治疗的患者;队列3为肿瘤携带非酪氨酸激酶结构域突变的患者。具体结果如下:
本研究针对三类患者群体开展主要分析:队列1为肿瘤携带酪氨酸激酶结构域突变的患者(75例);队列5为肿瘤携带酪氨酸激酶结构域突变且既往接受过HER2靶向抗体药物偶联物治疗的患者(31例);队列3为肿瘤携带非酪氨酸激酶结构域突变的患者(20例)。具体结果显示如下:
1、队列1:确认客观缓解率达71%(95%CI:60%~80%,与≤30%的基准相比P<0.001),中位缓解持续时间14.1个月(95%CI:6.9个月至无法评估),中位无进展生存期12.4个月(95%CI:8.2个月至无法评估);3级及以上药物相关不良事件发生率为17%(13例)。
2、队列5:确认客观缓解率48%(95%CI:32%~65%),3级及以上药物相关不良事件发生率仅3%(1例)。
3、队列3:确认客观缓解率30%(95%CI:15%~52%),3级及以上药物相关不良事件发生率25%(5例)。
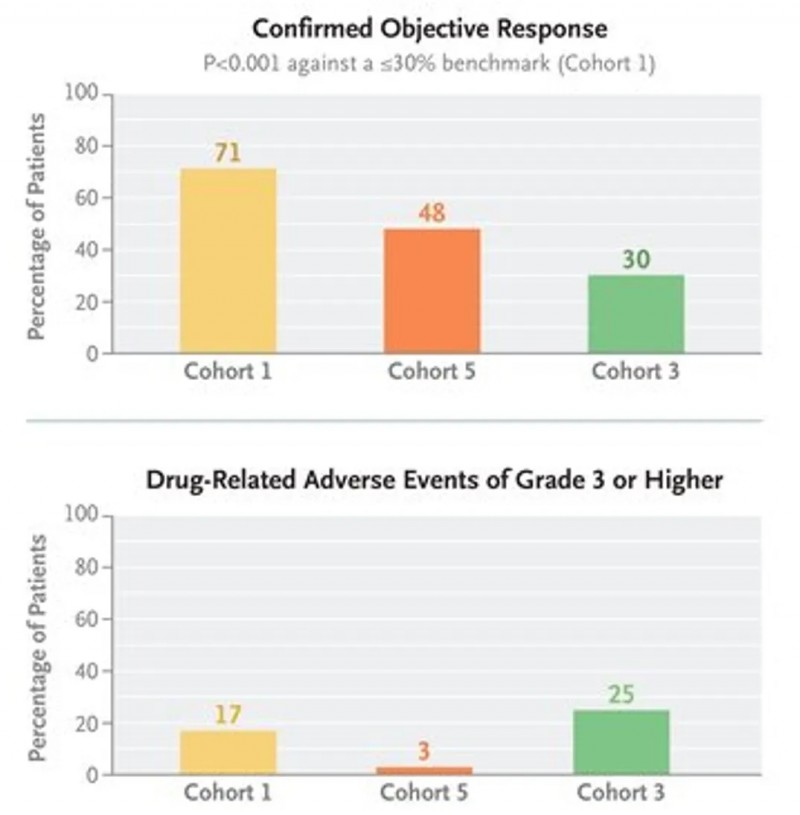
▲图源“N Engl J Med”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,Zongertinib 在既往接受过治疗的HER2突变型非小细胞肺癌患者中展现出明确临床获益,且不良事件以低级别为主,为该类患者提供了更便捷、安全的治疗新选择。
康奈非尼+化疗三联疗法方案:显著改善BRAF V600E突变转移性结直肠癌患者的生存率
BREAKWATER III期临床试验(NCT04607421)证实,针对BRAF V600E突变转移性结直肠癌患者,采用康奈非尼(Encorafenib,BRAF抑制剂)+西妥昔单抗(抗EGFR抗体)+mFOLFOX6化疗的联合靶向方案,较标准治疗实现了突破性生存获益——使BRAF V600E突变转移性结直肠癌患者的总生存期延长了一倍,达到30.3个月。该研究结果由共同首席研究员ScottKopetz医学博士发表于《新英格兰医学杂志》,为美国食品药品监督管理局(FDA)加速批准该联合方案作为此类患者一线治疗提供了关键依据,也进一步凸显了分子分型指导下靶向治疗对结直肠癌患者的重要价值。
该III期临床试验,共将未经治疗的BRAF V600E突变转移性结直肠癌患者(该亚型侵袭性强、预后不良)随机分为三组:康奈非尼+西妥昔单抗(EC)组、EC+mFOLFOX6组及标准治疗组(化疗联合或不联合贝伐珠单抗)。
结果显示:与标准治疗相比,EC+mFOLFOX6方案组的无进展生存期(PFS)显著延长,中位PFS分别为12.8个月 vs 7.1个月;疾病进展或死亡的风险比为0.53(95%CI:0.41~0.68;P<0.001)。
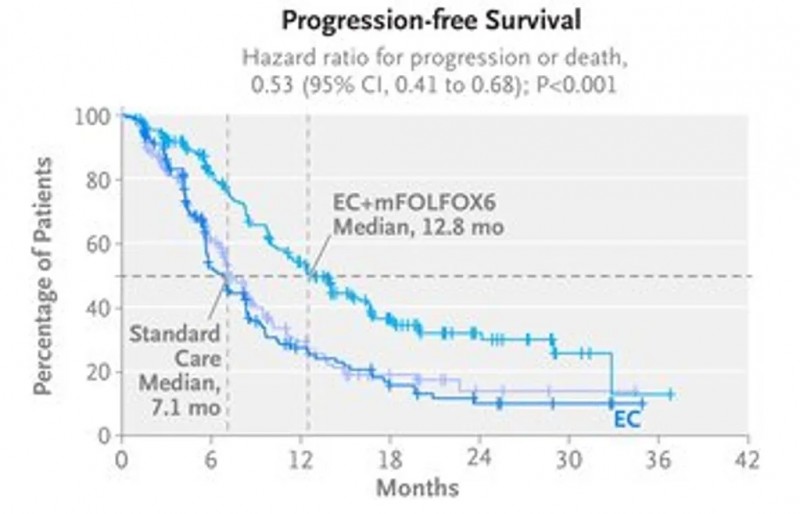
▲图源“N Engl J Med”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
中期分析显示,EC+mFOLFOX6方案组的总生存期(OS)也显著长于标准治疗组,中位OS分别为30.3个月 vs 15.1个月;死亡的风险比为0.49(95% CI:0.38~0.63;P<0.001)。治疗期间,EC+mFOLFOX6方案组的严重不良事件发生率为46.1%,标准治疗组为38.9%。
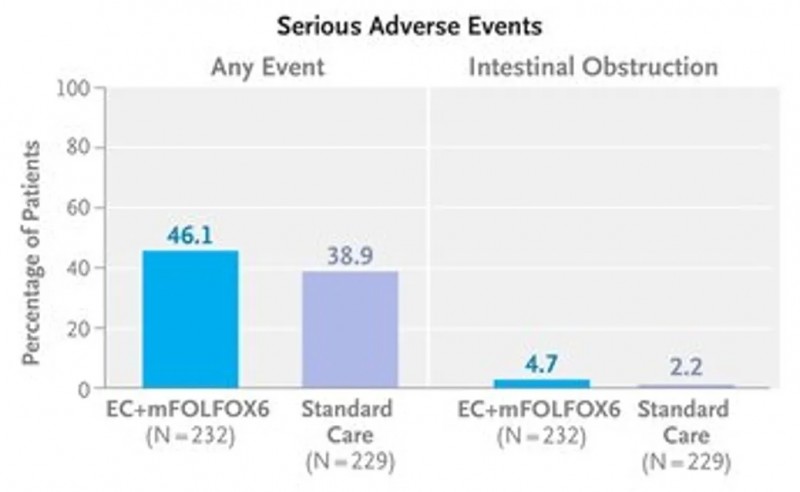
▲图源“N Engl J Med”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
术前靶向+免疫联合治疗:提高罕见甲状腺癌患者的生存率
一项II期多中心临床试验为BRAFV600E突变型间变性甲状腺癌(ATC,即甲状腺未分化癌)这一罕见难治性癌症带来突破性治疗进展。该研究聚焦术前新辅助治疗场景,评估了达拉非尼(BRAF靶向药)+曲美替尼(MEK靶向药)+帕博利珠单抗(PD-1免疫治疗药)三联疗法的临床疗效。
结果显示:患者中位无进展生存期从既往的6.7个月延长至一年以上,手术切除率更从仅5%飙升至74%,实现治疗效果的质的飞跃。这一方案的核心价值不仅在于大幅提升手术可切除率,让更多患者获得根治机会,更能显著降低癌症复发风险、延长患者生存期,为该类罕见癌症患者开辟了全新治疗路径。
小编寄语
癌症作为一种高度突变且极度狡猾的疾病,目前很难仅依靠单一疗法,达到预期治疗效果。现阶段理想的抗癌治疗,是依托于权威医院和权威专家的早期规范诊断,并在传统治疗(入手术、放化疗)的基础上,根据患者自身情况、疾病特点、经济状况等,辅以免疫细胞疗法(如CAR-T、TCR-T、TIL、NK、CAR-NK细胞疗法)、癌症疫苗、靶向药物、硼中子俘获疗法、质子治疗等抗癌新药/新技术,以预防癌症复发或转移、尽可能延长生存期、提高患者的生存质量。
对现阶段治疗方案不满意的患者,可将近期影像及病理检查报告、治疗经历等,提交至医学部,详细评估病情,或申请国内外抗癌专家会诊,寻求抗癌新药/新技术的帮助。
参考资料
[1]Roddie C,et al.Obecabtagene autoleucel in adults with B-cell acute lymphoblastic leukemia[J]. New England Journal of Medicine (NEJM), 2024.
https://www.nejm.org/doi/full/10.1056/NEJMoa2406526
[2]Biederstädt A,et al.Genome-wide CRISPR screens identify critical targets to enhance CAR-NK cell antitumor potency[J]. Cancer cell, 2025, 43(11): 2069-2088. e11.
https://www.cell.com/cancer-cell/fulltext/S1535-6108(25)00327-7
[3]Li X,et al.Large B cell lymphoma microenvironment archetype profiles[J]. Cancer Cell, 2025.
https://www.cell.com/cancer-cell/fulltext/S1535-6108(25)00228-4
[4]Dai Y,et al.PPP2R1A mutations portend improved survival after cancer immunotherapy[J]. Nature, 2025: 1-10.
https://www.nature.com/articles/s41586-025-09203-8
[5]Heymach J V,et al.Zongertinib in Previously Treated HER2-Mutant Non–Small-Cell Lung Cancer[J]. New England Journal of Medicine, 2025, 392(23): 2321-2333.
https://www.nejm.org/doi/full/10.1056/NEJMoa2503704
[6]Elez E,et al.Encorafenib, cetuximab, and mFOLFOX6 in BRAF-mutated colorectal cancer[J]. New England Journal of Medicine, 2025, 392(24): 2425-2437.
https://www.nejm.org/doi/full/10.1056/NEJMoa2501912
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
22款肺癌新药扎堆上市!2026这些基因
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
66.7%显著缩小 + 60周持续完全缓
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
"打一针"实现长期生
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

国研双抗突破实体瘤困局!首次人体研究结果
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
9cm巨大唾液腺肿瘤消失!新型靶向药改写
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

愈见大"CAR"|C
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




