死亡风险降低70%!全球首款实体瘤CAR-T疗法改写晚期胃癌治疗格局
全球首款实体瘤CAR-T治疗胃癌死亡风险降低70%
死亡风险显著降低70%!全球首款实体瘤CAR-T 疗法公布的最新研究数据振奋人心,有望改写晚期胃癌治疗格局!
胃癌是中国最常见的恶性肿瘤之一,2022 年发病率约为 35.9 万,死亡人数约为 26 万,成为全球胃癌发病率最高的国家之一。大家谈胃癌“色变”的重要原因是胃癌的难治性,大部分患者在确诊时都为晚期,虽然近两年靶向及免疫治疗取得了重大突破,但无进展生存期也仅为6个月,总生存期在8-14个月左右,胃癌患者迫切需要更好的治疗方案。
终于,中国研究人员成功研发了国际上首个针对胃癌,胰腺癌等实体瘤特异性靶点 Claudin18.2 的 CAR-T 细胞疗法--CT041(舒瑞基奥仑赛注射液,Satri-cel )。
死亡风险降低70%!全球首款实体瘤CAR-T疗法改写晚期胃癌治疗格局
2025 年 5 月 23 日,科济生物重磅宣布,舒瑞基奥仑赛治疗中国晚期胃/胃食管连接部癌(G/GEJC)的验证性II期临床试验(CT041-ST-01,NCT04581473)的研究结果摘要已在美国临床肿瘤学会(ASCO)网站上公布,引起巨大轰动!
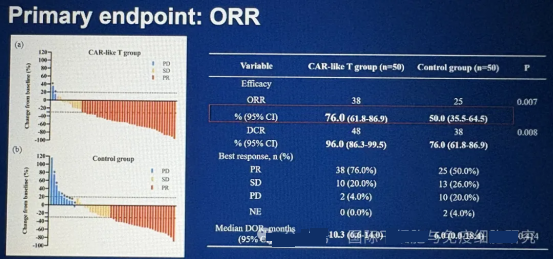
这项在中国开展的开放标签、多中心、随机对照试验 (RCT) 旨在比较 Satri-cel 与标准治疗 (SOC) 在 CLDN18.2 阳性、至少两线既往治疗失败的晚期胃食管交界处 (G/GEJC) 患者中的疗效和安全性。
当患者对传统治疗耐药后,往往陷入无药可医的绝境。研究团队采用 2:1 随机分组,156 例 CLDN18.2 阳性、至少两线治疗失败的患者被分为 Satri-cel 治疗组(104 例)与标准治疗(TPC)组(52 例)。Satri-cel 组接受 250×10⁶个细胞输注,最多 3 次;TPC 组则由医生选择阿帕替尼、紫杉醇等常规药物治疗。值得关注的是,TPC 组患者在病情进展或不耐受时,符合条件者可交叉接受 Satri-cel 治疗,这一设计更贴近真实临床场景。
数据截止至 2024 年 10 月 18 日的分析结果堪称震撼!
在所有随机患者(ITT 人群)中,Satri-cel 组中位无进展生存期(mPFS)达 3.25 个月,相较 TPC 组的 1.77 个月显著延长,疾病进展或死亡风险直降 63%!总生存期(OS)同样表现亮眼,Satri-cel 组 mOS 为 7.92 个月,较 TPC 组的 5.49 个月降低 30% 死亡风险。
而在实际接受治疗的患者(mITT 人群)中,Satri-cel 的优势更为显著:mPFS 延长至 4.37 个月(TPC 组 1.84 个月),疾病进展或死亡风险锐减 70%;mOS 达到 8.61 个月,较 TPC 组提升超 57%。更令人振奋的是,TPC 组中 20 例后续转用 Satri-cel 的患者,mOS 高达 9.20 个月;汇总所有接受 Satri-cel 输注的 108 例患者,mOS 达 9.17 个月,远超 TPC(医生选择的治疗) 组未接受该治疗患者的 3.98 个月,充分证实了 Satri-cel 的卓越疗效。
值得一提的是,这是全球首个实体瘤 CAR-T 疗法在中国开展的开放标签、多中心、随机对照试验(RCT),这项试验的成功,不仅为晚期 G/GEJC 癌患者点亮了生命之光,更标志着实体瘤细胞治疗时代的真正来临。随着 Satri-cel 加速迈向临床应用,我们有理由期待,未来将有更多癌症患者受益于这一创新疗法,见证生命奇迹的发生!
近日,全球首款Claudin18.2 CAR-T舒瑞基奥仑赛注射液再次传来喜讯:中国国家药监局药品审评中心(CDE)官网最新公示-CT041自体CAR T细胞注射液拟纳入优先审批,适应症为既往接受过至少二线治疗失败的Claudin18.2(CLDN18.2)表达阳性的晚期胃/食管胃结合部(G/GEJ)腺癌。更好的消息是,这款CAR-T预计将于2025年上半年向国家药品监督管理局(NMPA)提交上市申请!这意味着,如果一切顺利,舒瑞基奥仑赛注射液(satri-cel)将成为全球首个上市的实体瘤CAR-T产品,造福中国及全球胃癌患

晚期胃癌获得完全缓解!中国CAR-T疗法造福全球患者
2020年7月,美国FDA正式批准了中国的CAR-T疗法CT041开展临床实验,这项1b 期多中心开放标签研究 ( NCT04404595 )正在美国 6 个地点开展临床试验,众多美国胃癌患者已成功入组。近期,美国两家知名的癌症中心分别报道了两位幸运的患者达到完全缓解和部分缓解,这意味着,中国CAR-T疗法正站在世界舞台绽放璀璨光芒,造福全球患者!

30岁年轻晚期印戒细胞胃癌患者CAR-T治疗后获得完全缓解
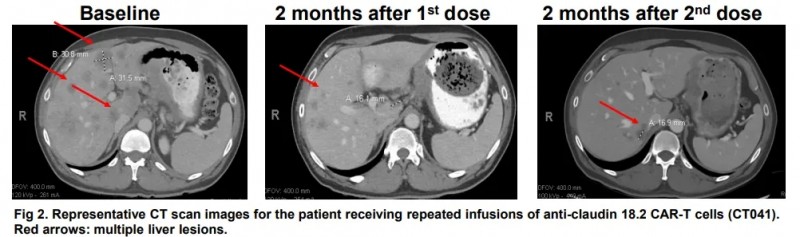
2019年12月,不到30 岁的M先生确诊为晚期胃印戒细胞癌,膀胱顶和腹膜壁转移。在接受了4种全身毒性化疗方案以及多次细胞减灭手术联合腹腔热灌注化疗 (HIPEC) 后,病情仍在在不断进展。
2021 年 5 月,M先生参加了CT-041 CAR-T细胞疗法在美国进行的临床试验,第一次CAR-T细胞回输后,他可以吃一些固体食物,并在约 5 个月后首次进行直肠排便。第二次回输后仅4 周,M先生的影像检查结果显示肿瘤靶病灶竟然全部消失,达到了完全缓解(CR),并且脾周结节和胃壁增厚完全消退,更让人无法相信的是,血液层面追踪体内残存细胞的ctDNA 检测结果显示为阴性,这意味着M先生体内已经没有分子残留疾病(MRD)!而且第二次回输M先生没有皮疹,他的精力水平显著提高,使他能够独立照顾孩子。在第一次 CT041 输注后 8 个月,M先生持续处于完全缓解状态!这也是海外报道的首例Claudin18.2 CAR-T治疗后达到完全缓解的胃癌患者!
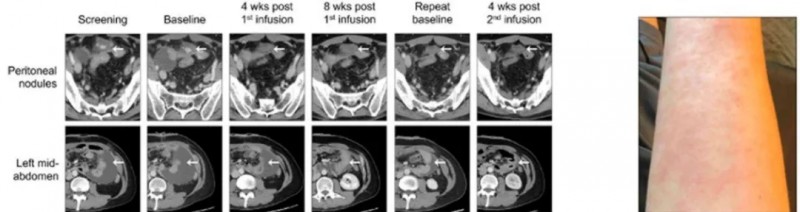
美国MD安德森公布治疗案例
全美癌症专科排名第一的MD安德森癌症中心在癌症免疫治疗学会(SITC)年会上公布了一例振奋人心的案例。
一名57岁男性的晚期胃癌(HER2阴性,PD-L1 CPS 10%)患者,肿瘤已经转移至肝脏,在接受5个周期的FOLFOX+Nivolumab方案和4个周期的FOLFIRI/Ramucirumab方案治疗后病情仍在不断进展。幸运的是,他在全美癌症专科排名第一MD安德森癌症进行了CLDN18.2的检测,显示为阳性,幸运的入组了全新的疗法--中国CAR-T的临床试验。
在预处理化疗后接受了第一次6亿个CT041细胞的治疗,影像显示肿瘤大小分别减小了19.2%、24.4%和26.9%。首次回输三个月后,患者接受了第二次6亿个CT041细胞的输注。CT扫描显示,与基线相比,肿瘤持续缩小,分别减小了34.6%(首次输注后4个月)和41.0%(首次输注后5个月)。
并且,这款CAR-T的安全性良好,截至目前,患者未报告发生严重不良事件,也未报告发生与胃肠道出血相关的不良事件(AE)。仅报告了短暂的3级或4级血液学毒性事件,其他所有AE均为1级或2级。
关于Satri-cel
Satri-cel 是中国科济生物自主研发的一款针对 Claudin18.2 的自体 CAR-T 细胞候选产品,用于胃癌/胃食管交界处癌 (GC/GEJ) 和胰腺癌 (PC)等 Claudin18.2 阳性实体瘤。正在全球进行多项临床试验:
●研究者发起的试验 (CT041-CG4006, NCT03874897);
●针对中国晚期 GC/GEJ 的确认性 II 期临床试验 (CT041-ST-01, NCT04581473);
●针对中国 PC 辅助治疗的 I 期临床试验 (CT041-ST-05, NCT05911217) ;
●针对北美晚期胃或胰腺腺癌的 1b/2 期临床试验 (CT041-ST-02, NCT04404595)。
2022 年 1 月,Satri-cel 获得美国 FDA 授予的再生医学先进疗法 (RMAT) 资格,用于治疗 Claudin18.2 阳性晚期 GC/GEJ 癌,并于 2021 年 11 月获得 EMA 授予的 PRIME 资格,用于治疗晚期胃癌。2020 年,Satri-cel 获得美国 FDA 授予的孤儿药资格,用于治疗 GC/GEJ,2021 年获得 EMA 授予的孤儿药资格,用于治疗晚期胃癌。
目前,中国首创 Claudin18.2 CAR-T(Satri-cel)GC/GEJ 关键 II 期临床试验患者入组也已经完成,我们期待这款卓越的疗法能够早日上市,造福更多的患者!
胃癌患者一定要检测的新兴靶点--Claudin18.2
Claudin 18.2是一个泛肿瘤的靶点,在多种上皮肿瘤当中都有表达,尤其在胃癌和胰腺癌中存在较高的表达。在胃癌或胃食管结合部癌中,高达60%的患者检测到Claudin 18.2的高度表达,成为近两年最具潜力的热门靶点,已有大量药物取得卓越的临床数据,为胃癌患者带来新曙光!
2024年6月25日,FDA批准zolbetuximab上市,联合含氟嘧啶和铂类化疗用于一线治疗治疗 CLDN18.2 阳性、不可切除、晚期或复发性胃癌或胃食管交界腺癌患者。这是第一个也是唯一一个靶向治疗患有CLDN18.2 阳性这种毁灭性疾病的新选择!

除了上面获批的药物,还有更多的新药正在研发中,包括ADC药物、MET抑制剂、PD-1/PD-L1抑制剂等等,大家可以根据当前疾病的发展情况以及分子分型进行选择,也可联系医学部了解详细招募标准,进行入组评估。
M108
试验药组:LM302注射液
药物介绍:CLDN18.2 ADC单克隆抗体
适合患者:无法手术切除初治胃癌,需要CLDN18.2 表达阳性。HER-2 阴性的胃和胃食管结合部腺。
TQB2103
试验药组:TQB2103
药物介绍:Claudin 18.2ADC
适合患者:标准治疗后不耐受或进展,需要CLDN18.2 表达检测。HER-2 阴性的胃和胃食管结合部腺癌。
相信上面这些在研药物给了晚期胃癌患者新的希望,同时也能看出,随着新型临床研究的推进,对检测提出了更高要求,需要全面了解患者的基因图谱 ,已经做了检测的病友可提交病历至医学部初步评估获得用药方案及临床试验推荐。相信胃癌患者的明天会越来越好。
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐

愈见大"CAR"|C
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

愈见大"CAR"|破
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
晚期肺癌治疗的"双保险&quo
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
全球首款双功能新药中国获批上市!另附20
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

全球肿瘤医生网官宣!GLOBE肿瘤创新药
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

改写乳腺癌宿命!mRNA疫苗+CD27抗
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




